题目内容
12.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1molCl2作为反应物,转移电子数一定为2NA | |
| B. | 25℃时,1.0LpH=13的Ba(OH)2溶液中水电离的OH-数目为0.1NA | |
| C. | 17g烃基和17gOH-含有的电子数均为10NA | |
| D. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体分子数小于NA |
分析 A.1mol Cl2发生反应时,与氢氧化钠溶液反应转移了1mol电子,与铁反应得到2mol电子;
B.pH=13的Ba(OH)2溶液中c(H+)=1.0×10-13mol/L,水电离的氢氧根离子数目等于水电离出的氢离子数目;
C.1个羟基含有9个电子,1个氢氧根离子含有10个电子;
D.二氧化氮气体中存在平衡:2NO2?N2O4.
解答 解:A.1mol Cl2发生反应时,与氢氧化钠溶液反应,氯气既是氧化剂也是还原剂,1mol氯气反应转移了1mol电子,转移的电子数是NA,故A错误;
B.pH=13的Ba(OH)2溶液中c(H+)=1.0×10-13mol/L,1L该溶液中水电离的H+物质的量为1.0×10-13mol,则水电离的OH-数目为1.0×10-13NA,故B错误;
C.1个羟基含有9个电子,17g羟基的物质的量为1mol,则17g羟基含有9mol电子,电子数为9NA;1个氢氧根离子含有10个电子,17gOH-的物质的量为1mol,则17gOH-含有10mol电子,电子数为10NA,故C错误;
D.NA个NO分子和0.5NA个O2分子混合后恰好完全反应生成1mol二氧化氮,但二氧化氮气体中存在平衡:2NO2?N2O4,导致分子个数减少,故气体分子个数小于NA个,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,注意羟基与氢氧根的关系.

练习册系列答案
相关题目
2.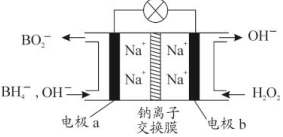 某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
 某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )| A. | 每消耗3mol H2O2,转移6mol e- | |
| B. | 电池工作时Na+从b极区移向a极区 | |
| C. | b极上的电极反应式为:H2O2+2e-═2OH- | |
| D. | a极上的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O |
3.工业上可用还原法制取某些金属单质,以下各项中不属于常用还原剂的是( )
| A. | C | B. | CO | C. | Al | D. | K |
20.下列有关说法正确的是( )
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | 将 0.1 mol•L-1NH4A1(SO4)2 溶液与 0.3 mol•L-1Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++40H-═AlO2-+2BaSO4↓+2H2O |
7.曲酸是一种非常有潜力的食品添加剂,结构如图所示.下列有关曲酸的叙述不正确的是( )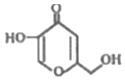

| A. | 分子中所有碳原子不可能共平面 | |
| B. | 能发生酯化反应、氧化反应、还原反应 | |
| C. | lmol该物质与H2完全加成,需消耗3mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有3种 |
17.下列有关装置I~Ⅳ的实验方法及操作的说法正确的是( )
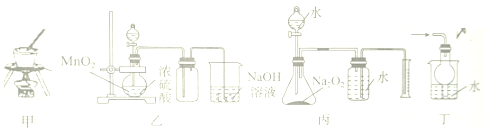

| A. | 利用甲装置甲从海水中提取NaCl晶体 | |
| B. | 利用装置乙制备并收集Cl2 | |
| C. | 利用装置丙测定变质Na2O2的纯度 | |
| D. | 利用装置丁吸收HCl尾气,防止液体倒吸 |
1.将0.2mol AgNO3、0.4mol Cu(NO3)2和0.6mol KCl溶于水配成100mL溶液,用惰性电极电解一段时间后,在一极上析出0.3mol Cu,此时,另一极上的气体体积(标准状况)为( )
| A. | 4.48 L | B. | 5.6 L | C. | 6.7 L | D. | 7.8 L |
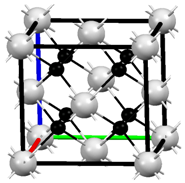 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题: