题目内容
1. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
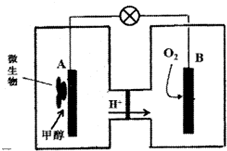
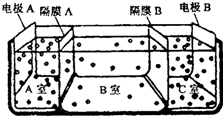
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
分析 (1)依据热化学方程式和盖斯定律计算将方程式3×①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)的反应热化学方程式;
(2)①甲醇在负极失电子发生氧化反应,A为负极,氧气在正极得到电子发生还原反应,B为正极,电子从负极经外电路流向正极;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变;
③A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成;
(3)①根据反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$计算;
②利用三段式计算平衡时各组分浓度,根据v=$\frac{△c}{△t}$计算反应速率;
(4)反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,提高一氧化碳的转化率可以增大氢气的量,降低温度、中等压强使平衡正向进行.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol①
CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol②
将方程式3×①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol;
(2)①甲醇在负极失电子发生氧化反应,A为负极,氧气在正极得到电子发生还原反应,B为正极,电子从负极经外电路流向正极.即电子由A极经外电路流向B极,
故答案为:从A到B;
②B电极反应是氧气得到电子生成氢氧根离子在酸性溶液中生成水,氢离子通过交换膜移向正极,氢离子物质的量不变,溶液体积变化忽略不计,溶液中氢离子浓度不变,故溶液pH不变,
故答案为:不变;
③A电极是原电池负极,甲醇失电子发生氧化反应,在酸溶液中生成二氧化碳,由电荷守恒可知有H+生成,电极反应式为:CH3OH+H2O-6e-═6H++CO2↑,
故答案为:CH3OH+H2O-6e-═6H++CO2↑;
(3)①该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,将所给浓度带入平衡常数表达式:$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,故答案为:>;
②2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol•L-1):0.44 0.6 0.6
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.44-2x 0.6+x 0.6+x
K=$\frac{(0.6+x)^{2}}{(0.44-2x)^{2}}$,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
起始时在密闭容器中加入CH3OH,
则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,
则10min转化甲醇1.64moL/L-0.04moL/L=1.6mol/L,
所以甲醇的反应速率为v(CH3OH)=$\frac{△c}{△t}$=$\frac{1.6mol/L}{10min}$=0.16 mol/(L•min),
故答案为:0.04 mol•L-1; 0.16 mol/(L•min).
(4)反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,反应是气体体积进行的放热反应,依据化学平衡移动原理分析,增大一氧化碳转化率,平衡正向进行,
a.分离出二甲醚平衡正向进行,一氧化碳转化率增大,故a正确;
b.加入催化剂改变反应速率不改变化学平衡,故b错误;
c.恒容条件充入He,使体系压强增大,气体分液不变,浓度不变,平衡不变,故c错误;
d.增加CO的浓度会提高氢气转化率,一氧化碳转化率减小,故d错误;
e.再充入1molCO和3molH2.相当于中等压强,平衡正向进行,一氧化碳转化率增大,故e正确;
故答案为:ae.
点评 本题考查较综合,涉及原电池原理、盖斯定律、化学平衡影响因素、化学反应速率的计算等知识点,主要是化学平衡影响因素的分析判断和平衡计算应用,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | H2,H2S,SO2 | B. | N2,Cl2,HBr | C. | CO2,O2,NO | D. | NH3,CO2,HCl |

| A. | 正极反应为:Zn-2e-═Zn2+ | |
| B. | 电池反应为:Zn+Cu2+═Zn2++Cu | |
| C. | 在外电路中,电子从铜电极流向锌电极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
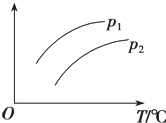 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H>0;平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H>0;平衡移动关系如图所示.下列说法正确的是( )| A. | p1<p2,纵坐标指A的体积分数 | |
| B. | p1>p2,纵坐标指C的质量分数 | |
| C. | p1<p2,纵坐标指A的转化率 | |
| D. | p1<p2,纵坐标指混合气体的平均摩尔质量 |
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 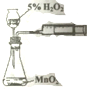 用图装置测定该化学反应速率 | D. | 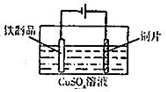 用图装置在铁制品表面镀铜 |
 某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )| A. | 断开K1闭合K2时,总反应的离子方程式为:2H++2Cl-$\stackrel{电解}{→}$ H2↑+Cl2↑ | |
| B. | 断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动 | |
| C. | 断开K1闭合K2时,铁电极附近溶液pH逐渐升高 | |
| D. | 断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法 |
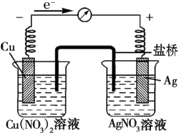 某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.
某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.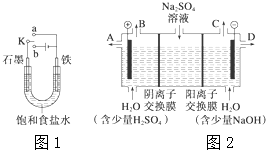 (1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题: