题目内容
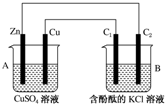
13. 某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极.实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )| A. | 断开K1闭合K2时,总反应的离子方程式为:2H++2Cl-$\stackrel{电解}{→}$ H2↑+Cl2↑ | |
| B. | 断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动 | |
| C. | 断开K1闭合K2时,铁电极附近溶液pH逐渐升高 | |
| D. | 断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法 |
分析 断开K1,闭合K2时,该装置是电解池,电解池工作时,两极均有气泡产生,说明铁电极是阴极,石墨电极是阳极,阳极上生成氯气,阴极上生成氢气;
断开K2,闭合K1时,该装置是原电池,铁作负极,石墨作正极,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应.
解答 解:A.断开K1闭合K2时,总反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+2OH-+Cl2↑,故A错误;
B.断开K1闭合K2时,为电解池,但电子不能流经溶液,故B错误;
C.断开K1闭合K2时,铁电极为阴极生成氢气,促进水的电离,溶液碱性增强,故C正确;
D.断开K2闭合K1时,该装置是原电池,铁易失电子作负极,石墨作正极,金属被腐蚀,故D错误.
故选C.
点评 本题综合考查电解池和原电池知识,注意把握电化学工作原理,为高考常见题型,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,难度中等.

练习册系列答案
相关题目
3.在一密闭容器中,反应 a A(g)═b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,则下列判断不正确的是( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b+c |
1. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
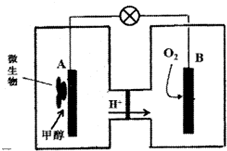
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:V正> V逆(填“>”“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
2.下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀.
①电离 ②电镀 ③电解 ④电化学腐蚀.
| A. | ①② | B. | ②③ | C. | ③④ | D. | 全部 |
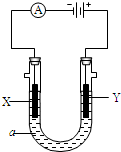 电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题: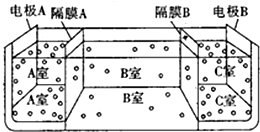
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:
 .
. .
. .
. .
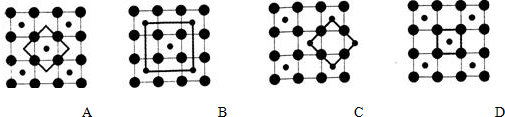
. 钴(Co)是人体必需的微量元素.含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用.请回答下列问题:
钴(Co)是人体必需的微量元素.含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用.请回答下列问题: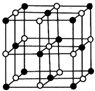 ,在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.
,在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.