题目内容
9.如图所示铜锌原电池工作时,下列叙述正确的是( )
| A. | 正极反应为:Zn-2e-═Zn2+ | |
| B. | 电池反应为:Zn+Cu2+═Zn2++Cu | |
| C. | 在外电路中,电子从铜电极流向锌电极 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,溶液中阳离子向正极移动,以此解答该题
解答 解:A.正极上铜离子得电子生成Cu,正极反应为Cu2++2e-=Cu,故A错误;
B.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C.电子从电池负极经外电路流向正极,即电子从锌电极流向铜电极,故C错误;
D.溶液中阳离子向正极移动,则盐桥中的K+移向CuSO4溶液,故D错误;
故选B.
点评 本题考查原电池的工作原理,注意把握原电池的工作原理以及电极方程式的书写,题目难度不大,注意电子流向和离子流向的判断.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
17.针对如图装置的说法中,正确是( )
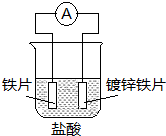

| A. | 溶液中pH值明显下降 | B. | 阴极的电极反应式:Fe-2e→Fe2+ | ||
| C. | 铁片为正极,镀锌铁片为负极 | D. | 电子由锌经溶液流向铁 |
14.下列说法正确的是( )
| A. | 氯碱工业是电解熔融的NaCl,阳极产生Cl2 | |
| B. | 氢氧燃料电池可将热能直接转化为电能 | |
| C. | 原电池工作时,电子从负极经外电路移向正极 | |
| D. | 工业上电解熔融的AlCl3来制取铝 |
1. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
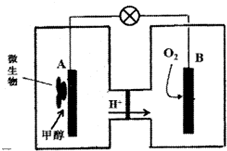
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:V正> V逆(填“>”“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.

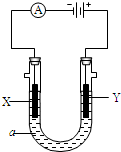 电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题: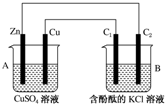 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: