题目内容
12.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是明矾、硫酸铝、硫酸铁、硫酸亚铁等(填其中任意两种)(填两种物质的名称),其净水作用的原理是铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物,并破坏水中带其他异电的胶体,使其聚沉达到净水的目的.
(2)水的净化与软化的区别是水的净化是通过混凝剂(如明矾等)将水中的胶体及悬浮物除去,而水的软化是使水中的Ca2+、Mg2+浓度减小.
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为10°.
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2740g,后加入Na2CO31484g.
(5)如图是电渗析法淡化海水的原理图.其中,电极A接直流电源的正极,电极B接直流电源的负极.
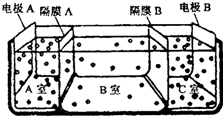
①隔膜A是阴离子交换膜(填“阴”或“阳”).
②某种海水样品,经分析含有大量的Na+,Cl-,以及少量的K+,SO42-.若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为pHa<pHb<pHc.
分析 (1)天然水在净化处理过程中加入的混凝剂,其净水原理是利用盐水解生成的胶体吸附水中悬浮物;
(2)净化水是除去悬浮杂质,软化水是除去钙镁离子;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)硬水软化需要把钙离子和镁离子全部沉淀,加入氢氧化钙和镁离子、碳酸氢根离子反应,加入碳酸钠沉淀钙离子;
(5)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;电解池的阴极是氢离子放电,阳极是氢氧根离子放电.
解答 解:(1)天然水在净化处理过程中加入的混凝剂可以是明矾、硫酸铝、硫酸铁、硫酸亚铁等(填其中任意两种),其净水作用的原理是铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物,并破坏水中带其他异电的胶体,使其聚沉达到净水的目的,
故答案为:明矾、硫酸铝、硫酸铁、硫酸亚铁等(填其中任意两种);
铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物,并破坏水中带其他异电的胶体,使其聚沉达到净水的目的;
(2)水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,
故答案为:水的净化是通过混凝剂(如明矾等)将水中的胶体及悬浮物除去,而水的软化是使水中的Ca2+、Mg2+浓度减小;
(3)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=$\frac{67.2mg}{10mg}$=10°故答案为:10°;
(4)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3mol•L-1=12mol;镁离子物质的量=10×103L×6×10-4mol•L-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4mol•L-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的 碳酸根离子为22mol-8mol=14mol,需要碳酸钠的质量为14mol×106g/mol=1484g,
故答案为:740;1484;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,故答案为:阴;
②电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,故答案为:pHa<pHb<pHc.
点评 本题考查电解原理、水的硬度及水的净化等知识点,为高频考点,明确电解池中各个电极发生的反应、水硬度计算方法是解本题关键,侧重考查学生分析计算能力,题目难度不大.

| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 过量铁粉溶于稀硝酸:Fe+NO3-+4H+═Fe3++2H2O+NO↑ | |
| C. | 氯气与水的反应:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀物质的量最大:2Al3++3 Ba2++3SO42-+6OH-═2Al(OH)3↓+3BaSO4↓ |
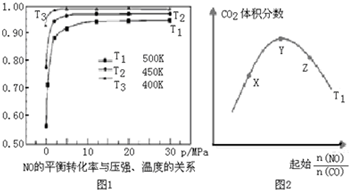
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b+c |
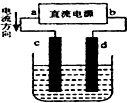
| A. | c、d电极上都有气体产生 | B. | d为阴极、c为阳极 | ||
| C. | d极附近溶液PH值升高 | D. | 电解过程中,氯离子浓度减小 |
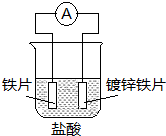
| A. | 溶液中pH值明显下降 | B. | 阴极的电极反应式:Fe-2e→Fe2+ | ||
| C. | 铁片为正极,镀锌铁片为负极 | D. | 电子由锌经溶液流向铁 |
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
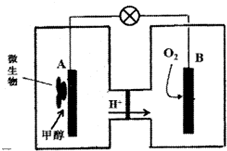
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
①电离 ②电镀 ③电解 ④电化学腐蚀.
| A. | ①② | B. | ②③ | C. | ③④ | D. | 全部 |
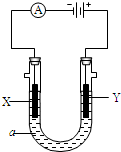 电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题: