题目内容
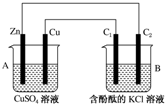
10.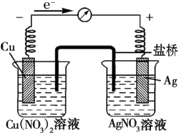 某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.
某探究小组将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)设计成原电池,某时刻的电子流向及电流表(A)指针偏转方向如图所示.请你参与探究并回答有关问题:
(1)该装置中负极是Cu,其电极反应为Cu-2e-=Cu2+.
(2)盐桥是含有琼脂的饱和KNO3溶液,电池工作时,盐桥中K+和N分别向正极和负极移动;工作一段时间后取出盐桥,电流表的指针将不再发生偏转.
(3)工作一段时间后,Cu(NO3)2溶液中c(Cu2+)将增大(填“增大”、“减小”或“不变”).
(4)实验前Cu电极和Ag电极质量相等,反应中转移0.5mol电子时,两极质量差为70g.
分析 (1)Cu失电子作负极,发生氧化反应生成铜离子;
(2)电解质溶液中阳离子向正极移动,阴离子向负极移动,取出盐桥后不能形成闭合回路;
(3)Cu(NO3)2溶液中Cu电极失电子生成铜离子;
(4)根据电极方程式结合转移电子守恒计算分析.
解答 解:(1)Cu失电子作负极,发生氧化反应生成铜离子,负极的电极方程式为Cu-2e-=Cu2+;
故答案为:Cu;Cu-2e-=Cu2+;
(2)电解质溶液中阳离子向正极移动,所以盐桥中K+向正极移动,阴离子向负极移动,则NO3+向负极移动;取出盐桥后不能形成闭合回路,不能构成原电池,所以电流表的指针将不再发生偏转;
故答案为:正;负;不再发生偏转;
(3)Cu(NO3)2溶液中Cu电极失电子生成铜离子,所以Cu(NO3)2溶液中c(Cu2+)将增大;故答案为:增大;
(4)已知正极:2Ag++2e-=2Ag,负极:Cu-2e-=Cu2+,电路中转移电子的物质的量为0.5mol,则正极质量增加0.5mol×108g/mol=54g,负极质量减少$\frac{1}{2}$×0.5mol×64g/mol=16,所以两极质量差为54+16=70g;
故答案为:70.
点评 本题考查学生原电池的工作原理以及电极反应和电子转移之间的关系知识,注意把握原电池的构成条件、电极方程式的书写等基础知识的积累,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
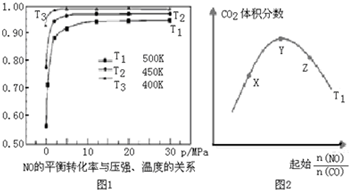
1. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
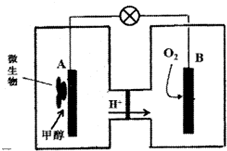
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:V正> V逆(填“>”“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.已知:25℃,101kPa下:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol;
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置.已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如图所示:
①电池外电路电子的流动方向为从A到B(填写“从A到B”或“从B到A”).
②工作结束后,B电极室溶液的酸性与工作前相比将不变(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计).
③A电极附近甲醇发生的电极反应式为CH3OH+H2O-6e-=6H++CO2↑;
(3)已知反应2CH3OH(g)═CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)=0.04mol•L-1;该时间内反应速率V(CH3OH)=0.16mol•L-1•min-1.
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g)═CH3OCH3(二甲醚) (g)+CO2(g)△H<0,要提高CO的转化率,可以采取的措施是ae(填字母代号)
a.分离出二甲醚 b.加入催化剂 c.充入He,使体系压强增大 d.增加CO的浓度
e.再充入1molCO和3molH2.
15.对于下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
2.下列过程需要通电才能进行的是( )
①电离 ②电镀 ③电解 ④电化学腐蚀.
①电离 ②电镀 ③电解 ④电化学腐蚀.
| A. | ①② | B. | ②③ | C. | ③④ | D. | 全部 |
20.如图所示,电极a和b均为石墨棒,在电解过程中,下列说法正确的是( )
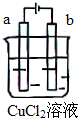

| A. | 电极a表面呈红色 | |
| B. | 电极b表面有气泡生成 | |
| C. | 电子由电源的负极沿导线流向电极b | |
| D. | 该装置能量转化形式为化学能转化为电能 |
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:
 .
. .
. .
. .
.