题目内容
2.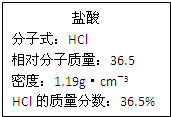 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸的物质的量浓度为11.9mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配制250mL物质的量浓度为0.7mol/L的稀盐酸.
①该学生用量筒量取14.7 mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有250mL容量瓶.
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是ADE(填字母).
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为dmol/L.(填选项字母)
a.$\frac{36.5a}{22.4(a+1)d}$ b.$\frac{1000ad}{36.5a+22.4}$ c.$\frac{ad}{36.5a+22.4}$ d.$\frac{1000ad}{36.5a+22400}$.
分析 (1)根据c=$\frac{1000ρω}{M}$计算出该浓盐酸的物质的量浓度;
(2)①根据配制过程中HCl的物质的量不变计算出需要浓盐酸体积;
②配制250mL的溶液需要选用规格为250mL的容量瓶;
③根据操作方法对c=$\frac{n}{V}$的影响进行判断产生的误差;
(3)根据n=$\frac{V}{{V}_{m}}$计算出该气体的物质的量,然后根据m=nM计算出其质量,1L水的质量约为1000g,从而可知溶液质量,然后根据V=$\frac{m}{ρ}$计算出溶液体积,最后根据c=$\frac{n}{V}$计算出该溶液的物质的量浓度.
解答 解:(1)该浓盐酸的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
故答案为:11.9;
(2)①配制250mL 0.7mol/L的稀盐酸,配制过程中氯化氢的物质的量不变,则需要11.9mo/L的浓盐酸的体积为:$\frac{0.7mol/L×0.25L}{11.9mol/L}$=0.0147L=14.7mL,
故答案为:14.7;
②配制250mL 0.7mol/L的稀盐酸,需要选用规格为250mL的容量瓶,配制该溶液还缺少250mL 容量瓶,
故答案为:250mL容量瓶;
③A.用量筒量取浓盐酸时俯视凹液面,量取的浓盐酸的体积偏小,配制的溶液浓度偏低,故A正确;
B.未恢复到室温就将溶液注入容量瓶并进行定容,配制的溶液体积偏小,溶液浓度偏高,故B错误;
C.容量瓶用蒸馏水洗后未干燥,对溶质的物质的量、最终溶液体积无影响,所以不影响配制结果,故C错误;
D.定容时仰视液面,配制的溶液体积偏大,溶液浓度偏低,故D正确;
E.未洗涤烧杯和玻璃棒,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故E正确;
故答案为:ADE;
(3)标准状况下aL气体的物质的量为:$\frac{aL}{22.4mol/L}$=$\frac{a}{22.4}$mol,该气体得到质量为:36.5g/mol×$\frac{a}{22.4}$mol=$\frac{36.5a}{22.4}$g,
所得溶液的质量为:1L×1000g/mL+$\frac{36.5a}{22.4}$g,所得溶液的体积为:$\frac{1000g+\frac{36.5a}{22.4}g}{1000dg/L}$=$\frac{22400+36.5a}{22400d}$L,
所以该溶液的物质的量浓度为:$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22400d}}$=$\frac{1000ad}{36.5a+22400}$mol/L,
故答案为:d.
点评 本题考查了物质的量浓度的计算、溶液配制方法,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意掌握配制一定浓度溶液的步骤,试题培养了学生的化学实验、化学计算能力.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 加入AgNO3溶液和稀盐酸,生成白色沉淀,可确定有Cl-存在 | |
| B. | 用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有钠盐 | |
| C. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- | |
| D. | 加入KSCN溶液,溶液不变红,再加氯水后溶液显红色,则原溶液一定含Fe2+ |
| A. | 滴定中涉及的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液常用硫酸酸化,若用HNO3酸化,会使测定结果偏低 | |
| C. | KMnO4标准溶液盛放在酸式滴定管中 | |
| D. | 该实验选择酚酞做指示剂,当待测液颜色由无色变为浅红色时即达到滴定终点 |
下列关系式中正确的是( )
| A. | b<a<0 | B. | b>a>0 | C. | a=b<0 | D. | a=b>0 |
| A. | 过量氨水溶液 | B. | 过量饱和Na2CO3 溶液 | ||
| C. | 过量CH3COOH 溶液 | D. | 过量蒸馏水 |
| A. | 53g碳酸钠中含NA个CO32- | |
| B. | 0.1molOH-含NA电子 | |
| C. | 22.4LHCl溶于水,溶液中H+数为NA | |
| D. | 标准状况下11.2L臭氧(O3)中含NA个氧原子 |
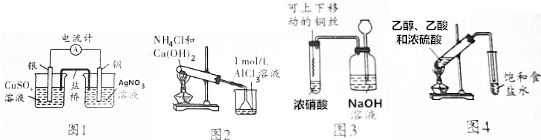
| A. | 用图1所示装置可将化学能转化为电能 | |
| B. | 用图2所示装置烧杯中先出现白色沉淀,后溶解 | |
| C. | 用图3所示装置进行铜与浓硝酸反应的实验 | |
| D. | 用图4所示装置制取乙酸乙酯 |
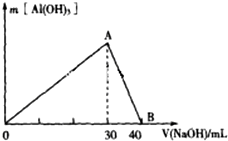 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.