题目内容
11.以NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 53g碳酸钠中含NA个CO32- | |
| B. | 0.1molOH-含NA电子 | |
| C. | 22.4LHCl溶于水,溶液中H+数为NA | |
| D. | 标准状况下11.2L臭氧(O3)中含NA个氧原子 |
分析 A、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含1mol碳酸根来分析;
B、氢氧根为10电子微粒;
C、HCl气体所处的状态不明确;
D、求出臭氧的物质的量,然后根据臭氧为3原子分子来分析.
解答 解:A、53g碳酸钠的物质的量为0.5mol,而1mol碳酸钠中含1mol碳酸根,故0.5mol碳酸钠中含0.5mol碳酸根即0.5NA个,故A错误;
B、氢氧根为10电子微粒,故0.1mol氢氧根中含1mol电子即NA个,故B正确;
C、HCl气体所处的状态不明确,故HCl气体的物质的量不能计算,则溶液中的氢离子的个数无法计算,故C错误;
D、标况下11.2L臭氧的物质的量为0.5mol,而臭氧为3原子分子,故0.5mol臭氧中含1.5mol氧原子即1.5NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
1.常温下,向2L恒容密闭容器中冲入1.0molM和1.0molN,发生如下反应:M(g)+N(g)?P(g).一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |
19.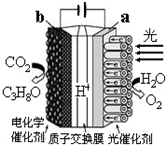 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和C3H8O.下列说法错误的是( )| A. | 该装置将光能和电能转化为化学能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每还原44 g CO2,理论上可生成33.6L O2 | |
| D. | b电极的反应为:3CO2+18H++18e-═C3H8O+5H2O |
6.工业上制乙醇的方法是( )
| A. | 淀粉发酵 | B. | 乙烯加水 | C. | 乙醛还原 | D. | 乙酸乙酯水解 |
3.用标准盐酸滴定氢氧化钠溶液(甲基橙作指示剂),下列操作正确的是( )
| A. | 锥形瓶用蒸馏水洗涤后,再用氢氧化钠溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定 | |
| C. | 滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化 | |
| D. | 当滴定至溶液由黄色变为橙色时,即为滴定终点 |
20.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂.工业上通过以下反应生产:
3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4+3NaCl+6NaNO3+5H2O
下列有关该反应的说法正确的是( )
3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4+3NaCl+6NaNO3+5H2O
下列有关该反应的说法正确的是( )
| A. | 氯元素的化合价升高 | B. | Fe(NO3)3是氧化剂 | ||
| C. | 铁元素被氧化 | D. | NaOH发生氧化反应 |
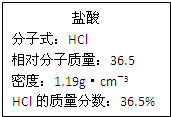 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: