题目内容
12.下列有关实验装置进行的相应实验,能达到实验目的是( )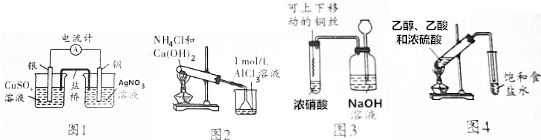
| A. | 用图1所示装置可将化学能转化为电能 | |
| B. | 用图2所示装置烧杯中先出现白色沉淀,后溶解 | |
| C. | 用图3所示装置进行铜与浓硝酸反应的实验 | |
| D. | 用图4所示装置制取乙酸乙酯 |
分析 A.含有盐桥的原电池中,电极材料与其对应的电解质具有相同的金属元素;
B.Al(OH)3能溶于强碱溶液但不能溶于弱碱溶液;
C.浓硝酸和铜反应生成二氧化氮,用氢氧化钠溶液吸收;
D.饱和食盐水不能和乙酸反应.
解答 解:A.含有盐桥的原电池中,电极材料与其对应的电解质具有相同的金属元素,即该装置中Cu、Ag互换才能构成原电池,故A错误;
B.加热条件下,氯化铵和氢氧化钙反应生成气体,氨气溶于水生成一水合氨,一水合氨和氯化铝反应生成氢氧化铝,Al(OH)3能溶于强碱溶液但不能溶于弱碱氨水溶液,所以烧杯中出现白色沉淀,但白色沉淀不溶解,故B错误;
C.浓硝酸和铜反应生成二氧化氮,二氧化氮有毒能污染空气,可用氢氧化钠溶液吸收,防止污染空气,故C正确;
D.饱和食盐水不能和乙酸反应,但饱和碳酸钠溶液能和乙酸反应生成可溶性的乙酸钠,能溶解乙醇,且能抑制乙酸乙酯溶解性,应该用饱和碳酸钠溶液,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、原电池原理、基本实验操作等知识点,侧重于学生的分析能力和实验能力的考查,明确实验原理及物质性质是解本题关键,注意氢氧化铝的两性,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.用标准盐酸滴定氢氧化钠溶液(甲基橙作指示剂),下列操作正确的是( )
| A. | 锥形瓶用蒸馏水洗涤后,再用氢氧化钠溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定 | |
| C. | 滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化 | |
| D. | 当滴定至溶液由黄色变为橙色时,即为滴定终点 |
20.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂.工业上通过以下反应生产:
3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4+3NaCl+6NaNO3+5H2O
下列有关该反应的说法正确的是( )
3NaClO+2Fe(NO3)3+10NaOH═2Na2FeO4+3NaCl+6NaNO3+5H2O
下列有关该反应的说法正确的是( )
| A. | 氯元素的化合价升高 | B. | Fe(NO3)3是氧化剂 | ||
| C. | 铁元素被氧化 | D. | NaOH发生氧化反应 |
1.已知:C(s)+CO2(g)?2CO(g)△H>0.该反应达到平衡后,下列条件有利于反应向逆方向进行的是( )
| A. | 升高温度和增大压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和减小压强 |
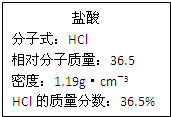 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: