题目内容
下列离子方程式正确的是( )
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| B、氧化铝溶解在NaOH溶液中:3H2O+Al2O3+2OH-?=2[Al(OH)4]-? |
| C、硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全Al3++SO42-?+Ba2++3OH-=BaSO4↓+Al(OH)3↓ |
| D、在漂白粉配制成的溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
考点:离子方程式的书写
专题:
分析:A.HI过量,硝酸根、三价铁离子都被还原;
B.氧化铝溶解在NaOH溶液中反应生成四羟基合铝酸钠;
C.离子个数不符合物质的配比;
D.次氯酸根具有强的氧化性能够氧化亚硫酸根离子.
B.氧化铝溶解在NaOH溶液中反应生成四羟基合铝酸钠;
C.离子个数不符合物质的配比;
D.次氯酸根具有强的氧化性能够氧化亚硫酸根离子.
解答:
解:A.Fe(NO3)3溶液中加入过量的HI溶液,离子方程式为:Fe3++3NO3-+12H++10I-═Fe2++5I2+6H2O+3NO↑,故A错误;
B.氧化铝溶解在NaOH溶液中反应生成四羟基合铝酸钠,离子方程式为:3H2O+Al2O3+2OH-?=2[Al(OH)4]-?,故B正确;
C.硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全,离子方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故C错误;
D.在漂白粉配制成的溶液中通入SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,故D错误;
故选:B.
B.氧化铝溶解在NaOH溶液中反应生成四羟基合铝酸钠,离子方程式为:3H2O+Al2O3+2OH-?=2[Al(OH)4]-?,故B正确;
C.硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全,离子方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故C错误;
D.在漂白粉配制成的溶液中通入SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,故D错误;
故选:B.
点评:本题考查离子反应方程式的书写,明确发生的反应是解答的关键,注意选项C中反应物用量对反应的影响,为易错点.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1.8g 水所含有的电子数目为NA |
| B、2g 氢气所含原子数为NA |
| C、常温常压下11.2L氧气所含分子数目为0.5NA |
| D、200 mL0.5mol?L-1Na2SO4溶液所含Na+数目0.1NA |
下列离子方程式中,正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氧化铜与稀盐酸混合:CuO+2H+=Cu2++H2O |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、氢氧化镁和盐酸混合:H++OH-=H2O |
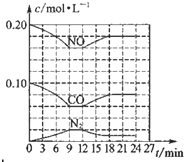 将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )
将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )| A、容器内的压强不发生变化说明该反应达到平衡 |
| B、当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C、第12 min时改变的反应条件为减小压强 |
| D、向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
下列反应的离子方程式书写正确的是( )
| A、氧化铜与盐酸反应 O2-+2H+=H2O |
| B、二氧化碳通入足量氢氧化钠溶液中:CO2+OH-=HCO3- |
| C、铝片与硫酸铜溶液反应:2Al+3Cu2+=2Al3++3Cu |
| D、氢氧化钡溶液与稀H2SO4 反应:H++OH-+Ba2++SO42-=BaSO4↓+H2O |
下列叙述正确的是( )
| A、同温同压下,物质的物质的量相等,其体积一定相同 |
| B、等体积的二氧化碳和一氧化碳所含的分子数一定相等 |
| C、1L氮气一定比1L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |
