题目内容
请用相应的化学式及方程式填空:
(1)从H、O、S、Na四种元素中,选择适当的元素填空(每空一种物质).
①碱性氧化物 ;②酸性氧化物 ;③含氧酸 ;④碱 ;⑤酸式盐 .
(2)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式: .
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,已知水是生成物之一.
①其中属于电解质的是 ;属于非电解质的是 .
② 是氧化剂; 是氧化产物.
③写出该反应的化学方程式并配平: .
(1)从H、O、S、Na四种元素中,选择适当的元素填空(每空一种物质).
①碱性氧化物
(2)写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的一个化学方程式:
(3)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,已知水是生成物之一.
①其中属于电解质的是
②
③写出该反应的化学方程式并配平:
考点:酸、碱、盐、氧化物的概念及其相互联系,氧化还原反应方程式的配平,电解质与非电解质
专题:物质的分类专题
分析:(1)碱性氧化物是能和酸反应生成盐和水的氧化物;酸性氧化物是能和碱反应生成盐和水的氧化物;含有氧元素的酸为含氧酸;阴离子全部是氢氧根的化合物是碱;能电离出氢离子的盐为酸式盐;
(2)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐;
(3)该反应中水是反应产物,根据元素守恒知,含有H元素的化合物为反应物,硝酸具有强氧化性,能被还原剂还原为NO,所以硝酸是反应物,硫化氢的还原性大于S,所以硫化氢是反应物,S是生成物,其反应方程式为3H2S+2HNO3=2NO↑+3S+4H2O,根据转移电子和水之间的关系式计算.
(2)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐;
(3)该反应中水是反应产物,根据元素守恒知,含有H元素的化合物为反应物,硝酸具有强氧化性,能被还原剂还原为NO,所以硝酸是反应物,硫化氢的还原性大于S,所以硫化氢是反应物,S是生成物,其反应方程式为3H2S+2HNO3=2NO↑+3S+4H2O,根据转移电子和水之间的关系式计算.
解答:
解:(1)碱性氧化物是能和酸反应生成盐和水的氧化物,Na2O是碱性氧化物;
酸性氧化物是能和碱反应生成盐和水的氧化物,SO2是酸性氧化物;
含有氧元素的酸为含氧酸,H2SO4为含氧酸;
阴离子全部是氢氧根的化合物是碱,NaOH为碱;
能电离出氢离子的盐为酸式盐,NaHSO4为酸式盐;
故答案为:Na2O;SO2;H2SO4;NaOH;NaHSO4;
(2)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐,如CO2+2NaOH=Na2CO3+H2O,故答案为:CO2+2NaOH=Na2CO3+H2O;
(3)①电解质是在水溶液中或熔融状态下能导电的化合物,故H2S、HNO3、H2O是电解质;非电解质是在水溶液中和熔融状态下均不能导电的化合物,故NO是非电解质,故答案为:H2S、HNO3、H2O;NO;
②该反应中水是反应产物,根据元素守恒知,含有H元素的化合物为反应物,HNO3具有强氧化性而作氧化剂,硫化氢的还原性大于S,所以硫化氢作还原剂,则S是还原产物,故答案为:HNO3;S;
③该反应的化学方程式为3H2S+2HNO3=3S↓+2NO↑+4H2O,故答案为:3H2S+2HNO3=3S↓+2NO↑+4H2O.
酸性氧化物是能和碱反应生成盐和水的氧化物,SO2是酸性氧化物;
含有氧元素的酸为含氧酸,H2SO4为含氧酸;
阴离子全部是氢氧根的化合物是碱,NaOH为碱;
能电离出氢离子的盐为酸式盐,NaHSO4为酸式盐;
故答案为:Na2O;SO2;H2SO4;NaOH;NaHSO4;
(2)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐,如CO2+2NaOH=Na2CO3+H2O,故答案为:CO2+2NaOH=Na2CO3+H2O;
(3)①电解质是在水溶液中或熔融状态下能导电的化合物,故H2S、HNO3、H2O是电解质;非电解质是在水溶液中和熔融状态下均不能导电的化合物,故NO是非电解质,故答案为:H2S、HNO3、H2O;NO;
②该反应中水是反应产物,根据元素守恒知,含有H元素的化合物为反应物,HNO3具有强氧化性而作氧化剂,硫化氢的还原性大于S,所以硫化氢作还原剂,则S是还原产物,故答案为:HNO3;S;
③该反应的化学方程式为3H2S+2HNO3=3S↓+2NO↑+4H2O,故答案为:3H2S+2HNO3=3S↓+2NO↑+4H2O.
点评:本题考查氧化还原反应,明确物质的性质是解本题关键,知道方程式的配平方法,知道常见元素化合价,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
关于1mol?L-1CaCl2溶液的下列说法正确的是( )
| A、溶液中c(Cl-)=2 mol?L-1 |
| B、由1mol CaCl2溶于1L水中制得 |
| C、溶液中含有1mol CaCl2 |
| D、1L 溶液中含2molCa2+,2mol Cl- |
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| B、1 L 0.1 mol/LNaHSO4溶液中含有0.1 NA个HSO4- |
| C、常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子 |
| D、1 mol铁与足量稀盐酸反应转移的电子数目为3NA |
下列离子方程式正确的是( )
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| B、氧化铝溶解在NaOH溶液中:3H2O+Al2O3+2OH-?=2[Al(OH)4]-? |
| C、硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全Al3++SO42-?+Ba2++3OH-=BaSO4↓+Al(OH)3↓ |
| D、在漂白粉配制成的溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
最近江苏省大部分地区遭受严重的雾霾天气,雾霾属于哪种分散系( )
| A、溶液 | B、胶体 |
| C、乳浊液 | D、悬浊液 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、气态氢化物稳定性:Y>T |
| B、五种元素中原子半径最大的是Z |
| C、R位于元素周期表中第二周期第ⅣA族 |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
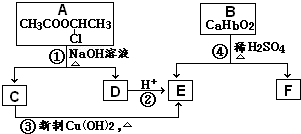 请根据如图作答:
请根据如图作答: