题目内容
下列离子方程式书写正确的是( )
| A、标况下2.24L CO2通入1 mol?L-1100mL氢氧化钠溶液中:CO2+OH-=HCO3- |
| B、硝酸铝溶液中加入过量氨水:Al3++4NH3?H2O=[Al(OH)4]-+4 NH4+ |
| C、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
| D、等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.根据二氧化碳与氢氧化钠的物质的量判断反应产物及反应的离子方程式;
B.氨水为弱碱,无法溶解氢氧化铝,铝离子与氨水反应生成氢氧化铝沉淀;
C.铁与稀硫酸反应生成亚铁离子,不会生成铁离子;
D.碳酸氢铵与氢氧化钠的物质的量相等,氢氧根离子不足,碳酸氢根离子优先反应.
B.氨水为弱碱,无法溶解氢氧化铝,铝离子与氨水反应生成氢氧化铝沉淀;
C.铁与稀硫酸反应生成亚铁离子,不会生成铁离子;
D.碳酸氢铵与氢氧化钠的物质的量相等,氢氧根离子不足,碳酸氢根离子优先反应.
解答:
解:A.标况下2.24L二氧化碳的物质的量为0.1mol,1 mol?L-1100mL氢氧化钠溶液中含有氢氧化钠0.1mol,等物质的量的二氧化碳与氢氧化钠反应生成碳酸氢钠,反应的离子方程式为:CO2+OH-=HCO3-,故A正确;
B.硝酸铝溶液中加入过量氨水,氨水无法溶解氢氧化铝,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.稀硫酸中加入铁粉,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故C错误;
D.等物质的量的NH4HCO3与NaOH在溶液中反应,氢氧化钠不足,碳酸氢根离子优先反应,铵根离子不反应,正确的离子方程式为:HCO3-+OH-=CO32-+H2O,故D错误;
故选A.
B.硝酸铝溶液中加入过量氨水,氨水无法溶解氢氧化铝,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.稀硫酸中加入铁粉,反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故C错误;
D.等物质的量的NH4HCO3与NaOH在溶液中反应,氢氧化钠不足,碳酸氢根离子优先反应,铵根离子不反应,正确的离子方程式为:HCO3-+OH-=CO32-+H2O,故D错误;
故选A.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,选项C为易错点,注意铁与稀硫酸反应生成硫酸亚铁.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
下列递变规律正确的是( )
| A、HClO4、H2SO4、H3PO4的酸性依次增强 |
| B、P、S、Cl最高正价依次降低 |
| C、钠、镁、铝的还原性依次减弱 |
| D、HCl、HBr、HI的稳定性依次增强 |
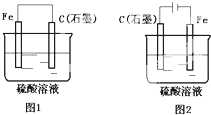 如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )
如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )| A、两装置中,铁电极上均有气体产生 |
| B、两装置中,石墨电极上均有气体产生 |
| C、石墨电极上发生的电极反应均为:2H++2e-=H2↑ |
| D、随着反应的进行,两装置中电解质溶液的酸性均减弱 |
水的电离过程为H2O?H++OH-,在不同温度下其平衡常数为KW(25℃)=1.0×10-14,K(35℃)=2.1×10-14下列叙述正确的是( )
| A、c(H+)随着温度的升高而降低 |
| B、35℃时纯水中c(H+)>c(OH-) |
| C、向水中加入NaHSO4溶液会抑制水的电离 |
| D、向水中加入NaHCO3溶液会抑制水的电离 |
NH3与HCl相遇,可观察到的现象是( )
| A、产生白雾 |
| B、产生白烟 |
| C、产生棕黄色的烟 |
| D、无明显现象 |
常温下,下列物质中与钠能反应且反应现象较平缓的是( )
| A、乙醇 | B、乙酸 | C、水 | D、苯 |
设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A、常温常压下,13.8g NO2气体溶于足量水,转移电子数为0.2NA |
| B、标准状况下,22.41.CH3CI含有的原子数为5NA |
| C、0.5mo1O2与11.2LO2所含的分子数一定相等 |
| D、常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、25℃1.01×105Pa?64克SO2中含有的原子数为3NA |
| C、22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、CO和N2分子含有的电子数相同,22.4L的CO气体与lmol N2所含的电子数相等 |