题目内容
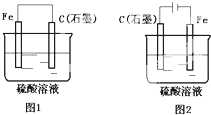 如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )
如图是化学能与电能相互转换的两套装置.对此两套装置的分析正确的是( )| A、两装置中,铁电极上均有气体产生 |
| B、两装置中,石墨电极上均有气体产生 |
| C、石墨电极上发生的电极反应均为:2H++2e-=H2↑ |
| D、随着反应的进行,两装置中电解质溶液的酸性均减弱 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:图1没有外接电源,符合原电池的构成条件,所以该装置是原电池,较活泼的金属铁作负极,石墨作正极,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应;图2有外接电源,所以是电解池,连接正极的石墨是阳极,连接负极的铁是阴极,阳极上氢氧根离子失电子发生氧化反应,阴极上氢离子得电子发生还原反应.
解答:
解:A、图1装置是原电池,较活泼的金属铁作负极,负极上铁失电子生成二价铁离子加入溶液,图2是电解池,连接负极的铁作阴极,阴极上氢离子得电子生成氢气,故A错误;
B、图2是电解池,铁做阴极,石墨是阳极,该极上氢氧根离子失电子生成氧气,图1装置是原电池,较活泼的金属铁作负极,石墨是正极,该极上是氢离子得电子生成氢气,即石墨电极上均有气体产生,故B正确;
C、图1装置是原电池,石墨作正极,正极上氢离子得电子生成氢气2H++2e-=H2↑;图2 是电解池,连接正极的石墨作阳极,阳极上氢氧根离子失电子生成氧气4OH--4e-=O2↑+2H2O,故C错误;
D、图1装置是原电池,石墨作正极,负极上铁失电子生成二价铁离子进入溶液,正极上氢离子得电子生成氢气2H++2e-=H2↑,导致溶液中氢离子浓度降低,溶液的PH值增大;图2装置是电解池,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,电解水,硫酸溶液浓度增大,pH值,变小,故D错误;
故选B.
B、图2是电解池,铁做阴极,石墨是阳极,该极上氢氧根离子失电子生成氧气,图1装置是原电池,较活泼的金属铁作负极,石墨是正极,该极上是氢离子得电子生成氢气,即石墨电极上均有气体产生,故B正确;
C、图1装置是原电池,石墨作正极,正极上氢离子得电子生成氢气2H++2e-=H2↑;图2 是电解池,连接正极的石墨作阳极,阳极上氢氧根离子失电子生成氧气4OH--4e-=O2↑+2H2O,故C错误;
D、图1装置是原电池,石墨作正极,负极上铁失电子生成二价铁离子进入溶液,正极上氢离子得电子生成氢气2H++2e-=H2↑,导致溶液中氢离子浓度降低,溶液的PH值增大;图2装置是电解池,阳极上氢氧根离子失电子生成氧气,阴极上氢离子得电子生成氢气,电解水,硫酸溶液浓度增大,pH值,变小,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,难度不大,会判断装置是原电池还是电解池是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现已知O3分子为V字形结构,O3在水中的溶解度和O2比较( )
| A、O3在水中的溶解度和O2一样 |
| B、O3在水中的溶解度比O2小 |
| C、O3在水中的溶解度比O2要大 |
| D、没办法比较 |
下列每组分别给出了两个量,其中可以组成一个物质的量公式的组合是( )
| ① | ② | ③ | ④ | ⑤ |
| 物质的微粒数 | 固体体积 | 标况下气体摩尔体积 | 溶质的质量分数 | 非标况下物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 标况下气体体积 | 溶液的体积 | 物质的摩尔质量 |
| A、①③⑤ | B、②③④ |
| C、①④⑤ | D、①③④ |
下列有机物命名正确的是( )
A、 2-乙基丙胺 2-乙基丙胺 |
B、 对二甲苯 对二甲苯 |
| C、CH3CH═CHCH3 丁烯 |
D、 2-甲基-1-丁烯 2-甲基-1-丁烯 |
近年来,我省以铁矿石为原料的产业发展迅猛,磁铁矿、赤铁矿、菱铁矿、褐铁矿等都得到了大力开发.下列有关说法正确的是( )
| A、据报道,庐江磁性材料产业“磁”力无穷,Fe2O3就是磁性氧化铁 |
| B、马钢(合肥)钢铁可用焦炭和铁矿石为原料炼铁,其原理是用焦炭直接还原化合态的铁 |
| C、为了证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液即可 |
| D、某厂利用铁矿石制得的FeS能除去污水中的Hg2+.可见相同条件下,Ksp(FeS)>Ksp(HgS) |
下列离子方程式书写正确的是( )
| A、标况下2.24L CO2通入1 mol?L-1100mL氢氧化钠溶液中:CO2+OH-=HCO3- |
| B、硝酸铝溶液中加入过量氨水:Al3++4NH3?H2O=[Al(OH)4]-+4 NH4+ |
| C、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
| D、等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O |
在下列各说法中,正确的是( )
| A、书写热化学方程式时任何反应条件都不能标注 |
| B、热化学方程式中的化学计量数表示物质的量,可以是分数 |
| C、任何酸与碱发生中和反应,生成1 mol H2O时放出的热量叫做中和热 |
| D、101KPa时,1 mol H2与在足量 O2中燃烧放出的热量就是H2的燃烧热 |

