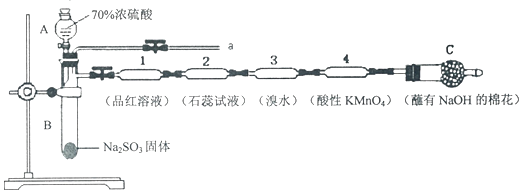
题目内容
8.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
分析 A.10Be和9Be互为同位素;
B.10Be的原子核内,质子数为4,中子数为10-4=6;
C.结合n=$\frac{m}{M}$、N=nNA计算;
D.26Al和26Mg的质子数分别为13、12,中子数分别为13、14,质子数等于核外电子数.
解答 解:A.10Be和9Be互为同位素,中子数不同质子数相同的不同原子,故A正确;
B.10Be的原子核内,质子数为4,中子数为10-4=6,中子数比质子数多,故B错误;
C.5.2g 26Al3+中所含的电子数约为$\frac{5.2g}{26g/mol}$×(13-3)×NA≈1.2×1024,故C正确;
D.26Al和26Mg的质子数分别为13、12,中子数分别为13、14,质子数等于核外电子数,质子数、中子数和核外电子数都不相同,故D正确;
故选B.
点评 本题考查物质的量的计算及原子中的数量关系,为基础性习题,侧重分析能力及计算能力、知识迁移应用能力的考查,注重基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
17.已知:2M(g)?N(g),△H=+100kJ•mol-1,下列说法不正确的是( )
| A. | 该反应的正反应的活化能大于100kJ•mol-1 | |
| B. | 加入适当催化剂,可以改变该反应历程 | |
| C. | 一定条件下,v正(M)=2v逆(N)时,该反应达到平衡状态 | |
| D. | 断裂2分子M中的化学键吸收的能量比断裂1分子N中的化学键吸收的能量多100kJ |
18.下列能正确表示基态氮原子的电子排布图的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
15.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1L2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| B. | 电解精炼铜时,若阴极得电子数为2NA,则阳极质量减少64g | |
| C. | 1mol聚苯乙烯分子有碳碳双键的数目为NA | |
| D. | 1molMg在空气中燃烧生成MgO(含少量Mg3N2)失去电子数为2NA |
3.“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣.
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
【实验结论】(1)A中产生的气体是氧气 ;
(2)实验 III证明:氧化铁的化学性质和质量在反应前后均没有发生变化,可以作
过氧化氢分解的催化剂;
【实验评价】实验设计的目的是进行对比.
【实验拓展】
查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂.
下列有关催化剂的说法中正确的是BC.
A.二氧化锰只能作过氧化氢溶液分解的催化剂.
B.同一个化学反应可以有多种催化剂
C.催化剂的质量和性质在化学反应前后都不改变.
D.用作催化剂的物质不可能是其他反应的反应物或生成物.
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验 II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. | / |
(2)实验 III证明:氧化铁的化学性质和质量在反应前后均没有发生变化,可以作
过氧化氢分解的催化剂;
【实验评价】实验设计的目的是进行对比.
【实验拓展】
查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂.
下列有关催化剂的说法中正确的是BC.
A.二氧化锰只能作过氧化氢溶液分解的催化剂.
B.同一个化学反应可以有多种催化剂
C.催化剂的质量和性质在化学反应前后都不改变.
D.用作催化剂的物质不可能是其他反应的反应物或生成物.
13.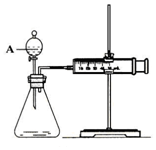 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
(1)检查该装置气密性的方法是将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好.
(2)仪器A的名称是分液漏斗.
(3)0-t时间段与t-2t时间段,化学反应速率最快的是t-2t,原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0,1mol/LFeCl3、0.2mol/LCuCl2,完成表的实验设计:
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目: .
.
②上表中需要添加的物质是4mlFeCl3溶液.
③本实验需要测定的数据是收集相同体积的氧气所需时间(或相同时间产生氧气的体积).
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表.
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而加快(填“加快”、“减慢”或“不变”).
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入0.3 g的MnO2为较佳选择.
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?不正确(填“正确”或“不正确”),理由是H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多.(提示:H2O2溶液的密度可认为近似相等.)
 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
(2)仪器A的名称是分液漏斗.
(3)0-t时间段与t-2t时间段,化学反应速率最快的是t-2t,原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0,1mol/LFeCl3、0.2mol/LCuCl2,完成表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
.②上表中需要添加的物质是4mlFeCl3溶液.
③本实验需要测定的数据是收集相同体积的氧气所需时间(或相同时间产生氧气的体积).
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如表.
 | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而加快(填“加快”、“减慢”或“不变”).
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入0.3 g的MnO2为较佳选择.
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?不正确(填“正确”或“不正确”),理由是H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多.(提示:H2O2溶液的密度可认为近似相等.)
20.A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大.下列有关叙述错误的是( )
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素A、C电负性大小关系为A>C |
18.下列关于有机化合物的说法正确的是( )
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 | |
| D. | 乙酸溶于水可以电离,属于离子化合物 |