题目内容
8.下列说法中,正确的是( )| A. | SiO2和CO2常温都是气体分子 | |
| B. | CO2、SiO2均能和氢氟酸反应 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | CO2、SiO2分别是H2CO3、H2SiO3的酸酐,因而均可由CO2、SiO2与水反应制得相应酸 |
分析 A.SiO2无分子存在,为原子晶体,CO2常温是气体分子;
B.CO2和氢氟酸不反应,SiO2能和氢氟酸反应;
C.能和碱反应生成盐和水的氧化物为酸性氧化物;
D.某含氧酸脱去一分子水或几分子水,所剩下的部分称为该酸的酸酐,SiO2和水不反应.
解答 解:A.二氧化硅是由硅原子和氧原子按照个数比1:2通过Si-O键构成原子晶体,常温是固体,无分子存在,CO2是由二氧化碳分子之间通过范德华力结合构成的分子晶体,常温是气体分子,故A错误;
B.CO2和氢氟酸不反应,氢氟酸与二氧化硅反应生成四氟化硅和水,故B错误;
C.CO2和SiO2均能和碱反应生成盐和水,属于酸性氧化物,在一定条件下都能和氧化钙反应,分别生成碳酸钙和硅酸钙,故C正确;
D.某含氧酸脱去一分子水或几分子水,所剩下的部分称为该酸的酸酐,所以CO2、SiO2分别是碳酸和硅酸的酸酐,CO2和水反应生成H2CO3,SiO2和水不反应,用SiO2和NaOH溶液制备硅酸钠,然后用硅酸钠和HCl溶液反应制备硅酸,故D错误;
故选C.
点评 本题考查了常见的分子晶体和原子晶体,侧重于二氧化碳和二氧化硅的性质的考查,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
18.下列叙述正确的是( )
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 |
19.下列解释过程或事实的方程式不正确的是( )
| A. | 检验Fe2+:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ | |
| B. | 打磨过的铝片与NaOH溶液反应产生气体:2Al+2OH-═2AlO2-+H2↑ | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 白色的Fe(OH)2在空气中变为红褐色:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
16.下列物质中,能与稀盐酸反应的有( )
| A. | Cu | B. | CaCO3 | C. | Zn | D. | AgNO3 |
13. 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度增大,则反应的焓变△H>0,熵变△S<0(分别填“>”、“<”、或“=”).
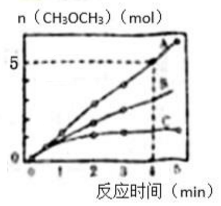
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示.
①图中0-4min内的反应速率v(CO2)=1.25mol•(L•min)-1.该温度下平衡常数的表达式为$\frac{{c(C{H_3}OC{H_3})}}{{{c^2}(C{O_2}){c^6}({H_2})}}$.
②下列有关说法正确的是ABC(填字母序号).
A.反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为2:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如表所示:
①P1>P2(填“>”、“<”或“=”);判断理由为压强增大,平衡向正反应方向移动,从而导致生成物的量增大.
②X1=0.05mol.
③P2下,III中CH3OCH3的平衡转化率为96%.
 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).(1)已知一定压强下,该反应在温度升高时,CH3OCH3(g)的浓度增大,则反应的焓变△H>0,熵变△S<0(分别填“>”、“<”、或“=”).
(2)相同条件下,在体积为2L的密闭容器内选用不同的催化剂,生成物二甲醚CH3OCH3的量随时间变化如图所示.
①图中0-4min内的反应速率v(CO2)=1.25mol•(L•min)-1.该温度下平衡常数的表达式为$\frac{{c(C{H_3}OC{H_3})}}{{{c^2}(C{O_2}){c^6}({H_2})}}$.
②下列有关说法正确的是ABC(填字母序号).
A.反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C)
B.升高温度能使反应速率加快,是因为活化分子百分数增大
C.单位时间内消耗CO2与生成H2的数目为2:1时,说明反应已经达到平衡
D.增大压强,平衡正向移动,平衡常数K值增大
(3)温度下,在体积可变的密闭容器中,改变起始时各物质的起始投料量,在不同的压强下,平衡时生成物二甲醚CH3OCH3(g)的物质的量如表所示:
| 序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
| I | 2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
| III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
②X1=0.05mol.
③P2下,III中CH3OCH3的平衡转化率为96%.
20.中华传统文化博大精深,其中涉及到很多的化学知识.下列有关说法不正确的是( )
| A. | 《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其中的矾指的是金属硫化物 | |
| B. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”涉及的反应为置换反应 | |
| C. | 西晋刘琨《重赠卢谌》中的诗句“何意百炼钢,化为绕指柔”中包含有化学变化 | |
| D. | 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO•CuO•4SiO2 |
17.已知:2M(g)?N(g),△H=+100kJ•mol-1,下列说法不正确的是( )
| A. | 该反应的正反应的活化能大于100kJ•mol-1 | |
| B. | 加入适当催化剂,可以改变该反应历程 | |
| C. | 一定条件下,v正(M)=2v逆(N)时,该反应达到平衡状态 | |
| D. | 断裂2分子M中的化学键吸收的能量比断裂1分子N中的化学键吸收的能量多100kJ |
18.下列能正确表示基态氮原子的电子排布图的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |