题目内容
17.已知在元素周期表中六种元素,X、Y、Z、W、Q、R原子序数依次减小.回答下列问题:(1)X元素与Y元素相邻,与X元素处于同一纵行的元素形成的单质的熔点、沸点随元素的原子序数的增大而增大,Y元素的含氧酸有多种,它的单质和氧化物都是强氧化剂,都可用作自来水的消毒剂,X位于周期表的0族,写出实验室制备Y的单质的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O.
(2)Y、Z、W三个原子的最外层共有11个电子,且三种元素形成的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,写出Y、Z、W三种元素的最高价氧化物对应水化物反应的离子方程式H++Al(OH)3═Al3++3H2O、H++OH-═H2O、Al(OH)3+OH-═AlO2-+2H2O
(3)Q、R两元素单原子形成的离子在水中不存在,与水作用使水溶液呈碱性,R形成单质的电子式为
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.(4)在一定温度下,R、Q形成的化合物在密闭容器中可发生下列反应:
2R2Q3(g)?4RQ(g)+Q2(g);反应到达平衡后,若恒容条件下通入一定量的氦气,则R2Q3的转化率不变,若在恒压条件下通入一定量的氦气,则R2Q3的转化率增大.(填“增大”“减小”“不变”)
分析 (1)X元素与Y元素相邻,与X元素处于同一纵行的元素形成的单质的熔点、沸点随元素的原子序数的增大而增大,Y元素的含氧酸有多种,它的单质和氧化物都是强氧化剂,都可用作自来水的消毒剂,则X为Ar,Y为Cl;
(2)Y、Z、W三个原子的最外层共有11个电子,且三种元素形成的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,结合原子序数可知,Z为Al,W的最外层电子为11-7-3=1,则W为Na;
(3)Q、R两元素单原子形成的离子在水中不存在,与水作用使水溶液呈碱性,可知Q为O,R为N;
(4)在一定温度下,R、Q形成的化合物在密闭容器中可发生下列反应:2N2O3(g)═4NO(g)+O2(g);反应到达平衡后,若恒容条件下通入一定量的氦气,各组分浓度不变,平衡不移动;若在恒压条件下通入一定量的氦气,则平衡体系中压强减小,平衡正向移动.
解答 解:(1)X元素与Y元素相邻,与X元素处于同一纵行的元素形成的单质的熔点、沸点随元素的原子序数的增大而增大,Y元素的含氧酸有多种,它的单质和氧化物都是强氧化剂,都可用作自来水的消毒剂,则X为Ar,位于周期表0族,Y为Cl,实验室制备Y的单质的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O,
故答案为:0;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O;
(2)Y、Z、W三个原子的最外层共有11个电子,Y为Cl,且三种元素形成的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水,结合原子序数可知,Z为Al,W的最外层电子为11-7-3=1,则W为Na,Y、Z、W三种元素的最高价氧化物对应水化物反应的离子方程式为H++Al(OH)3═Al3++3H2O、H++OH-═H2O、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:H++Al(OH)3═Al3++3H2O、H++OH-═H2O、Al(OH)3+OH-═AlO2-+2H2O;
(3)Q、R两元素单原子形成的离子在水中不存在,R的氢化物与水作用使水溶液呈碱性,可知Q为O,R为N,氮气的电子式为 ,W与R形成的化合物的化学式为 Na3N,含离子键,为离子晶体,
,W与R形成的化合物的化学式为 Na3N,含离子键,为离子晶体,
故答案为: ;Na3N;离子;
;Na3N;离子;
(4)在一定温度下,R、Q形成的化合物在密闭容器中可发生下列反应:2N2O3(g)═4NO(g)+O2(g);反应到达平衡后,若恒容条件下通入一定量的氦气,各组分浓度不变,平衡不移动,则转化率不变;若在恒压条件下通入一定量的氦气,则平衡体系中压强减小,平衡正向移动,则转化率增大,
故答案为:不变;增大.
点评 本题考查原子结构与元素周期律、位置与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识、化学平衡移动及化学键等综合应用,题目难度中等.

| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$.
(2)某温度下,平衡浓度符合下式:c2(SO3)=c(O2)•c2(SO2),试判断此时的温度为830℃.
(3)设在一定体积的密闭容器中充入0.30mol O2(g)和0.60mol SO2(g),反应在一定条件下达到平衡时,SO3的物质的量分数(SO3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$,该条件下O2的平衡转化率为$\frac{2}{3}$;该条件下反应2SO3(g)?O2(g)+2SO2(g)的平衡常数K=40.
(4)当O2与SO2混合气体以不同比例混合时,测得其平均相对分子质量分别为57.6和44.8,取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,分别求出O2在上述混合气体中的体积分数20%、60%.
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都减小,平衡向逆反应方向移动 |
 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
| A. | 使用的实验仪器是容量瓶和烧杯 | |
| B. | 静置后所得液体上层呈紫红色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功 |
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
| A. | Na2O→NaOH | B. | Fe→FeCl2 | C. | CuO→Cu | D. | H2O2→H2O |
 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题: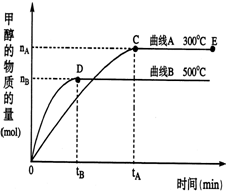 一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题:
一定条件下,在体积为2L的密闭容器中,一氧化碳与氢气在催化剂作用反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).根据题意完成下列各题: