题目内容
有一澄清透明溶液,只可能含有较大量的Fe3+、Ba2+、I-、F-、Cl-、H+、Na+、SO42-等离子中的两种或多种,现进行以下实验:
(1)取溶液少量加入铁粉,有气体放出.
(2)再取少量原溶液,通入SO2气体,有白色沉淀生成.
由此判断原溶液中一定含有的离子是 ;一定不含有的离子是 ;可能含有的离子是 ,若要确定该离子是否存在需要进行 实验(填实验名称或方法).
(1)取溶液少量加入铁粉,有气体放出.
(2)再取少量原溶液,通入SO2气体,有白色沉淀生成.
由此判断原溶液中一定含有的离子是
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)取溶液少量加入铁粉,有气体放出,则该气体为氢气,故含有H+,那么F-不能存在;
(2)再取少量原溶液,通入SO2气体,有白色沉淀生成,故一定含有Ba2+,那么原溶液中不含有SO42-,即二氧化硫与强氧化性物质反应生成硫酸根,故一定含有Fe3+、,那么原溶液中一定不会含有I-,溶液依据电中性原则判断氯离子的存在,据此分析解答即可.
(2)再取少量原溶液,通入SO2气体,有白色沉淀生成,故一定含有Ba2+,那么原溶液中不含有SO42-,即二氧化硫与强氧化性物质反应生成硫酸根,故一定含有Fe3+、,那么原溶液中一定不会含有I-,溶液依据电中性原则判断氯离子的存在,据此分析解答即可.
解答:
解:(1)取溶液少量加入铁粉,有气体放出,则生成的气体应为氢气,故溶液中一定含有H+,那么弱酸根离子F-不能存在;
(2)再取少量原溶液,通入SO2气体,有白色沉淀生成,故一定含有Ba2+,那么原溶液中不含有SO42-,即二氧化硫与强氧化性物质反应生成硫酸根,故一定含有Fe3+,那么原溶液中一定不会含有I-,依据溶液呈电中性判断,溶液中一定含有一种阴离子,即为:Cl-,
据此判断原溶液中一定含有的离子是:Fe3+、Ba2+、H+、Cl-,一定不含有的离子是:I-、F-、SO42-;可能含有的离子是:Na+,若要确定Na+是否存在需要进行焰色反应实验,若灼烧该溶液,出现黄色火焰,则含有钠离子,否则不含有,故答案为:Fe3+、Ba2+、H+、Cl-;I-、F-、SO42-;Na+;焰色反应.
(2)再取少量原溶液,通入SO2气体,有白色沉淀生成,故一定含有Ba2+,那么原溶液中不含有SO42-,即二氧化硫与强氧化性物质反应生成硫酸根,故一定含有Fe3+,那么原溶液中一定不会含有I-,依据溶液呈电中性判断,溶液中一定含有一种阴离子,即为:Cl-,
据此判断原溶液中一定含有的离子是:Fe3+、Ba2+、H+、Cl-,一定不含有的离子是:I-、F-、SO42-;可能含有的离子是:Na+,若要确定Na+是否存在需要进行焰色反应实验,若灼烧该溶液,出现黄色火焰,则含有钠离子,否则不含有,故答案为:Fe3+、Ba2+、H+、Cl-;I-、F-、SO42-;Na+;焰色反应.
点评:本题主要考查的是离子的判定、验证元素是否存在的方法:焰色反应,属于常考题.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
2L甲气体和1L乙气体恰好完全反应生成2L丙气体(所有气体的体积均在标准状况下测定).若丙气体的分子式是XY2,则甲、乙的分子式可能是( )
| A、X2和Y2 |
| B、YX2和Y2 |
| C、X2和XY |
| D、XY和Y2 |
下列离子的检验正确的是( )
| A、某溶液中滴入盐酸,生成无色气体,说明原溶液中一定有CO32- |
| B、某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中一定有Cu2+ |
| C、某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中一定有SO42- |
| D、某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中一定有Cl- |
0.5L AlCl3溶液中Cl-为1.5mol.则AlCl3溶液的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
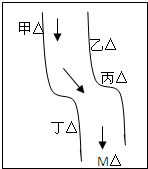 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断: 已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.
已知A~F是前4周期元素,原子序数依次增大,A是所有元素中原子半径最小的元素,B、C、D为第二周期相邻元素,C是同周期元素中未成对电子数最多的,E是第三周期元素中第一电离能最大的主族元素,F处于周期表的ds区,核外有1个未成对电子.