题目内容
已知A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子,向试管A的溶液中滴入酚酞试液呈红色.请回答下列问题:
(1)试管A的溶液中所含上述离子共有 种.
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为 (填“A”或“B”).
(3)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为 .
(4)若向由试管A溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为 .
(1)试管A的溶液中所含上述离子共有
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为
(3)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为
(4)若向由试管A溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:试管A的溶液中滴入酚酞试液呈红色,说明溶液显碱性,一定含有OH-,根据离子共存原理,一定没有Ag+、Mg2+,一定含有K+;试管B中一定含有Ag+、Mg2+,则一定没有Cl-,一定含有NO3-;
(1)根据试管A和B中含有的离子进行分析;
(2)根据A、B溶液中存在的离子形成反应的离子方程式;
(3)设出物质的量都为1mol进行计算即可;
(4)形成碳酸氢根离子与氢氧化钡溶液反应的离子方程式.
(1)根据试管A和B中含有的离子进行分析;
(2)根据A、B溶液中存在的离子形成反应的离子方程式;
(3)设出物质的量都为1mol进行计算即可;
(4)形成碳酸氢根离子与氢氧化钡溶液反应的离子方程式.
解答:
解:(1)试管A一定含有OH-、K+,一定没有Ag+、Mg2+,试管B一定含有Ag+、Mg2+、NO3-,一定没有Cl-,则Cl-在A中,故A中共有3种离子,故答案为:3;
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管中含有Ag+,为试管B,故答案为:B;
(3)设KOH、KCl、Mg(NO3)2、AgNO四种物质均为1mol,溶解于试管中,过滤后所得滤液中含有2molK+、0.5mol Mg2+、3mol NO3-,则n(K+):n(Mg2+):n(NO3-)=4:1:6;
故答案为:n(K+):n(Mg2+):n(NO3-)=4:1:6;
(4)向KHCO3溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O,故答案为:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O.
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管中含有Ag+,为试管B,故答案为:B;
(3)设KOH、KCl、Mg(NO3)2、AgNO四种物质均为1mol,溶解于试管中,过滤后所得滤液中含有2molK+、0.5mol Mg2+、3mol NO3-,则n(K+):n(Mg2+):n(NO3-)=4:1:6;
故答案为:n(K+):n(Mg2+):n(NO3-)=4:1:6;
(4)向KHCO3溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O,故答案为:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O.
点评:本题考查了离子共存及离子方程式的书写,充分考查了学生对所学知识的掌握情况,注意掌握离子反应发生的条件及离子方程式的书写方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
某盐的混合物中含有0.2molNa+,0.4molMg2+,0.4molCl- 和SO42-,则其含有的SO42-( )
| A、0.1mol |
| B、0.3 mol |
| C、0.5 mol |
| D、0.15 mol |
下列离子方程式正确的是( )
| A、氯化亚铁溶中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| B、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法正确的是( )


| A、甲为AlCl3,乙为NaHCO3 |
| B、溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42- |
| C、在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、白色沉淀A可能溶解在溶液D中 |
 品红溶液
品红溶液 溴水
溴水 澄清石灰水
澄清石灰水
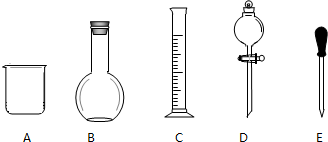 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.