题目内容
研究物质的微观结构,有助于人们理解物质变化的本质.请回答:
(1)C、Si、N元素的电负性由大到小的顺序是 ,C60和金刚石互为 ,金刚石熔点 C60的熔点(高于,低于),原因是 ;
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式 ;
A与B元素金属性由强到弱的顺序 ;
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”);
(4)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
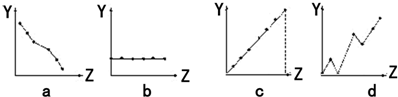
①ⅡA族元素的价电子数 .
②第三周期元素的最高化合价 .
③F-、Na+、Mg2+、Al3+的离子半径 .
(1)C、Si、N元素的电负性由大到小的顺序是
(2)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式
A与B元素金属性由强到弱的顺序
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(4)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
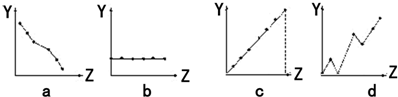
①ⅡA族元素的价电子数
②第三周期元素的最高化合价
③F-、Na+、Mg2+、Al3+的离子半径
考点:元素电离能、电负性的含义及应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:(1)根据元素的电负性在周期表中的递变规律以及晶体的类型与熔沸点的关系解答该题;
(2)由表中数据可知A、B最外层电子数为2,位于相同主族,根据电离能的大小可知B为Mg元素,根据能量最低原理书写电子排布式,依据第一电离能越小,金属性越强判断;
(3)判断Mn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(4)①根据同一主族元素的最外层电子数相等;
②第3周期的最高化合价从左→右依次升高;
③四种离子有相同的电子层结构,核电荷数越小,离子半径越大.
(2)由表中数据可知A、B最外层电子数为2,位于相同主族,根据电离能的大小可知B为Mg元素,根据能量最低原理书写电子排布式,依据第一电离能越小,金属性越强判断;
(3)判断Mn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(4)①根据同一主族元素的最外层电子数相等;
②第3周期的最高化合价从左→右依次升高;
③四种离子有相同的电子层结构,核电荷数越小,离子半径越大.
解答:
解:(1)同周期元素从左到右元素的电负性逐渐增强,则电负性:N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>C>Si,C60与金刚石都为碳元素的单质,故互称同素异形体,C60是分子晶体,而金刚石是原子晶体,原子晶体的熔沸点远大于分子晶体,
故答案为:N>C>Si;同素异形体;高于;金刚石是原子间以共价键相结合的原子晶体;而C60是分子间以分子间作用力形成的分子晶体,共价键键能远远大于分子间作用力;
(2)由表中数据可知A、B最外层电子数为2,位于相同主族,根据电离能的大小可知B为Mg元素,原子序数为12,核外电子排布式为1s22s22p63s2,B的第一电离能小于A,故B活泼,即B的金属性强,
故答案为:1s22s22p63s2;B>A;
(3)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色,
故答案为:有;
(4)①ⅡA族元素的最外层电子数相等,图象b符合,故答案为:b;
②第3周期的最高化合价从左→右依次升高,图象c符合,故答案为:c;
③四种离子有相同的电子层结构,核电荷数越小,离子半径越大,故离子半径:F->Na+>Mg2+>Al3+,图象a符合,故答案为:a.
故答案为:N>C>Si;同素异形体;高于;金刚石是原子间以共价键相结合的原子晶体;而C60是分子间以分子间作用力形成的分子晶体,共价键键能远远大于分子间作用力;
(2)由表中数据可知A、B最外层电子数为2,位于相同主族,根据电离能的大小可知B为Mg元素,原子序数为12,核外电子排布式为1s22s22p63s2,B的第一电离能小于A,故B活泼,即B的金属性强,
故答案为:1s22s22p63s2;B>A;
(3)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色,
故答案为:有;
(4)①ⅡA族元素的最外层电子数相等,图象b符合,故答案为:b;
②第3周期的最高化合价从左→右依次升高,图象c符合,故答案为:c;
③四种离子有相同的电子层结构,核电荷数越小,离子半径越大,故离子半径:F->Na+>Mg2+>Al3+,图象a符合,故答案为:a.
点评:本题考查较为综合,涉及多个方面的知识,题目难度较大,本题注意晶体类型以及对数据的分析和判断,学习中注重相关基础知识和解题方法的积累.

练习册系列答案
相关题目
在无色、酸性溶液中,能大量共存的是( )
| A、Ba2+、Cl-、NO3-、Na+ |
| B、K+、Cu2+、SO42-、Cl- |
| C、Na+、K+、CO32-、SO42- |
| D、Mg2+、SO42-、OH-、NO3- |
 品红溶液
品红溶液 溴水
溴水 澄清石灰水
澄清石灰水
 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.