题目内容
现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)B的化学式为 ,D的化学式为 .
(2)写出E溶液与过量的NaOH溶液反应的离子方程式 .
(3)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应的离子方程式为: .
(4)设计实验检验E中所含的阴离子: .
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)B的化学式为
(2)写出E溶液与过量的NaOH溶液反应的离子方程式
(3)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应的离子方程式为:
(4)设计实验检验E中所含的阴离子:
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,A为碳酸钠、C是盐酸;综上所述,A、B、C、D、E分别为:碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;据此解答即可.
解答:
解:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为:碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;
(1)依据以上分析得知B是氢氧化钡,化学式为Ba(OH)2;D为硝酸银,化学式为:AgNO3,故答案为:Ba(OH)2;AgNO3;
(2)硫酸铝和过量的氢氧化钠反应,方程式为Al2(SO4)3+8NaOH═2NaAlO2+3Na2SO4+4H2O,离子方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)盐酸溶液逐滴加入等体积、等物质的量的浓度的碳酸钠溶液中,HCl与碳酸钠反应生成等物质的量的NaHCO3和NaCl,离子反应方程式为CO32-+H+=HCO3-,
故答案为:CO32-+H+=HCO3-;
(4)E为硫酸铝,故含有的阴离子是硫酸根,硫酸根的检验方法为:取少量硫酸铝溶液于试管中,滴加少量稀盐酸,再滴加少量氯化钡溶液,若产生白色沉淀,则说明含有硫酸根,反之则不含有,故答案为:取少量硫酸铝溶液于试管中,滴加少量稀盐酸,再滴加少量氯化钡溶液,若产生白色沉淀,则说明含有硫酸根,反之则不含有.
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为:碳酸钠、氢氧化钡、盐酸、硝酸银、硫酸铝;
(1)依据以上分析得知B是氢氧化钡,化学式为Ba(OH)2;D为硝酸银,化学式为:AgNO3,故答案为:Ba(OH)2;AgNO3;
(2)硫酸铝和过量的氢氧化钠反应,方程式为Al2(SO4)3+8NaOH═2NaAlO2+3Na2SO4+4H2O,离子方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)盐酸溶液逐滴加入等体积、等物质的量的浓度的碳酸钠溶液中,HCl与碳酸钠反应生成等物质的量的NaHCO3和NaCl,离子反应方程式为CO32-+H+=HCO3-,
故答案为:CO32-+H+=HCO3-;
(4)E为硫酸铝,故含有的阴离子是硫酸根,硫酸根的检验方法为:取少量硫酸铝溶液于试管中,滴加少量稀盐酸,再滴加少量氯化钡溶液,若产生白色沉淀,则说明含有硫酸根,反之则不含有,故答案为:取少量硫酸铝溶液于试管中,滴加少量稀盐酸,再滴加少量氯化钡溶液,若产生白色沉淀,则说明含有硫酸根,反之则不含有.
点评:本题考查知识点较多,根据离子的共存、离子的性质来推断物质是解答本题的关键,综合性强,难度较大,学生需熟悉水解、离子反应等知识.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列离子方程式正确的是( )
| A、氯化亚铁溶中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| B、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、氧化铜溶于硫酸:O2-+2H+=H2O |
| D、碳酸钙溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
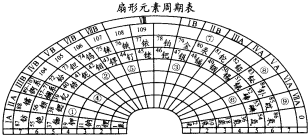
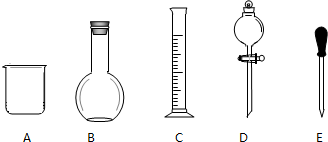 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.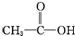 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④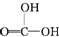 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.