题目内容
0.5L AlCl3溶液中Cl-为1.5mol.则AlCl3溶液的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、1 mol?L-1 |
| C、3 mol?L-1 |
| D、1.5 mol?L-1 |
考点:物质的量浓度的相关计算
专题:
分析:根据氯化铝的组成计算出氯化铝的物质的量,最后根据c=
计算出氯化铝溶液的物质的量浓度.
| n |
| V |
解答:
解:1molAlCl3溶液中含有3mol氯离子,AlCl3溶液中Cl-为1.5mol,氯化铝的物质的量为n(AlCl3)=
×1.5mol=0.5mol,该氯化铝溶液的物质的量浓度为c(AlCl3)=
=
=1mol/L,
故选B.
| 1 |
| 3 |
| n |
| v |
| 0.5mol |
| 0.5L |
故选B.
点评:本题考查了物质的量浓度的计算,题目难度不大,要求掌握物质的量与物质的量浓度之间的转化关系,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3-、CO32-、Cl-、NO3-、SO42-中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成.经分析:反应后的溶液中的阴离子的种类没有变化.则下列说法不正确的是( )
| A、若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B、原溶液中一定不含有HCO3-或CO32- |
| C、原溶液中一定含有Ba2+、Al3+ |
| D、若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g |
在无色、酸性溶液中,能大量共存的是( )
| A、Ba2+、Cl-、NO3-、Na+ |
| B、K+、Cu2+、SO42-、Cl- |
| C、Na+、K+、CO32-、SO42- |
| D、Mg2+、SO42-、OH-、NO3- |
通过一个阶段的复习,你认为下列说法正确的是( )
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
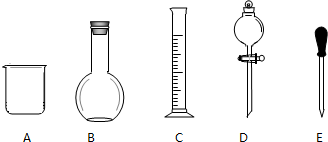 实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.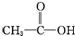 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④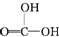 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.