题目内容
9.请完成下列各题的填空:(1)氢化钠(NaH)电子式为Na+[:H]-,氢负离子的离子结构示意图为
 .
.(2)元素X的最外层电子数是次外层电子数的2倍,该元素名称是碳,该元素核外电子排布式为1s22s22p2,画出该元素的外围电子排布图2s22p2.
(3)前四周期元素中,未成对电子数为5的元素符号是Mn,该元素在周期表中的位置为四周期,ⅤⅡB族,d区.
(4)C、N、O的第一电离能由大到小的顺序为N>O>C,由这三种元素和氢原子共同组成的离子化合物的化学式为NH4HCO3或者(NH4)2CO3.
(5)亚硒酸根离子(SeO32-)的VSEPR模型为四面体型,其中心原子的轨道杂化方式为sp3.
(6)向硫酸铜溶液中逐滴加入氨水至得到蓝色透明溶液后,再加入极性较小的溶剂乙醇,析出深蓝色晶体Cu(NH3)4SO4•H2O,该晶体中配离子为Cu2+,配离子中的配位体为NH3,配位数为4.
分析 (1)NaH是离子化合物,阴离子是H-,结构示意图为 ;
;
(2)根据原子核外电子的排列情况是:第一层排满了只能排2个电子,第二层排满了只能排8个电子,最外层不能超过8个电子分析;
(3)前四周期元素中,未成对电子数为5即外围电子排布图为3d54s2,原子序数为25,据此分析;
(4)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;根据组成离子化合物,则为铵盐,据此答题;
(5)中心原子S原子孤电子对数为$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4;
(6)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键,据此分析.
解答 解:(1)NaH是离子化合物,阴离子是H-,NaH的电子式为Na+[:H]-,氢负离子的离子结构示意图为 ,故答案为:Na+[:H]-;
,故答案为:Na+[:H]-; ;
;
(2)原子核外电子的排列情况是:第一层排满了只能排2个电子,第二层排满了只能排8个电子,最外层不能超过8个电子,由某元素的原子最外层电子数是次外层电子数的2倍,所以该元素核外电子只能有两层,所以第一层是2,第二层是4,所以质子数是6,所以是碳元素,核外电子排布式为1s22s22p2,外围电子排布图为2s22p2,故答案为:碳;1s22s22p2;2s22p2;
(3)前四周期元素中,未成对电子数为5即外围电子排布图为3d54s2,原子序数为25即为Mn,该元素在周期表中的位置为第四周期,ⅤⅡB族,d区,故答案为:Mn;四;ⅤⅡB;d;
(4)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到小的顺序为N>O>C;由这三种元素和氢原子共同组成的离子化合物的化学式为NH4HCO3或者(NH4)2CO3,故答案为:N>O>C;NH4HCO3或者(NH4)2CO3;
(5)中心原子S原子孤电子对数为$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4,则中心原子的轨道杂化方式为sp3,SeO32-离子的VSEPR构型为四面体型,故答案为:四面体型;sp3;
(6)NH3中N原子提供孤对电子,Cu2+提供空轨道,二者形成配位键,则该晶体中配离子为Cu2+,配离子中的配位体为NH3,配位数为4;故答案为:Cu2+;NH3;4.
点评 本题考查较综合,涉及电子排布、周期表位置确定、第一电离能、杂化方式、空间构型以及配合物的组成等,侧重原子结构与性质的考查,题目难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 油脂的主要成分是高级脂肪酸的甘油酯属于酯类 | |
| B. | 油脂易溶于水 | |
| C. | 天然油脂大多由混甘酯分子构成的混合物 | |
| D. | 脂肪里饱和烃基的相对含量较大,熔点 较高 |
| 元素编号 | 元素性质或原子结构的相关叙述 |
| T | 失去一个电子后,形成与Ne相同的核外电子排布 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
| Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
(2)Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是O3.
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是NaCl(写化学式).
(4)画出T的原子结构示意图:
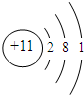 .
.(5)由X元素组成的单质在Y元素组成的常见单质中燃烧,生成的产物是CO2或CO.
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: