题目内容
某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤: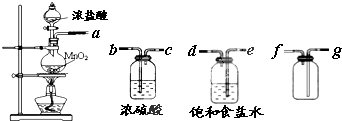
(1)用下列实验装置制取干燥纯净的氯气
①写出实验室制氯气的离子反应方程式 .
②制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为 (填仪器接口的字母编号).
③该实验还存在不足之处,应如何改进? .
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②: ;假设③: .
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空.
由此得出结论:假设 成立(填序号①②③).
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是 (填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体.

(1)用下列实验装置制取干燥纯净的氯气
①写出实验室制氯气的离子反应方程式
②制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为
③该实验还存在不足之处,应如何改进?
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空.
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | 固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含 |
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体.
考点:探究物质的组成或测量物质的含量,性质实验方案的设计
专题:实验设计题
分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯气、水和氯化锰,氯气中含有氯化氢和水蒸气,先用饱和食盐水除去氯化氢,再通过浓硫酸吸收水蒸气得到干燥氯气,洗气装置导气管是长进短出;收集气体需要用向上排气法收集,导气管长进短出,氯气有毒,注意不能排放到空气中,应有尾气处理装置;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)a通过实验验证为FeCl3
A.依据沉淀转化原理是向更难溶的方向进行;
B.铁和三价铁之间反应生成亚铁离子;
C.沸水中氯化铁水解生成氢氧化铁胶体;
D.溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,氢氧化铁加热分解生成氧化铁.
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)a通过实验验证为FeCl3
A.依据沉淀转化原理是向更难溶的方向进行;
B.铁和三价铁之间反应生成亚铁离子;
C.沸水中氯化铁水解生成氢氧化铁胶体;
D.溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,氢氧化铁加热分解生成氧化铁.
解答:
解:(1)①浓盐酸和二氧化锰在加热条件下反应生成氯气、水和氯化锰,反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
②制备并收集得到干燥纯净的氯气,氯气中含有氯化氢和水蒸气,需要通过洗气瓶除去,先用饱和食盐水除去氯化氢,再通过浓硫酸吸收水蒸气得到干燥氯气,洗气装置导气管是长进短出;收集气体需要用向上排气法收集,导气管长进短出;连接顺序是a、e、d、b、c、g、f;故答案为:a、e、d、b、c、g、f;
③氯气有毒污染空气,需要在装置的最后连接装有氢氧化钠溶液的尾气吸收装置;
故答案为:装置的最后需要连接装有氢氧化钠溶液的尾气吸收装置;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl2;FeCl3和FeCl2;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2;证明假设①正确;
故答案为:溶液变红色;FeCl2;①;
(3)A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,依据沉淀转化原理,反应向更难溶的分析进行,证明Fe(OH)3溶解度小于Mg(OH)2溶解度;故A正确;
B.铁和三价铁之间反应生成亚铁离子,溶液颜色变化为黄色变化为浅绿色;故B错误;
C.三价铁在沸水中水解生成氢氧化铁胶体,故C错误;
D.溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,灼烧得到Fe2O3固体,故D正确,
故答案为:AD.
| ||
故答案为:MnO2+4H++2Cl-
| ||
②制备并收集得到干燥纯净的氯气,氯气中含有氯化氢和水蒸气,需要通过洗气瓶除去,先用饱和食盐水除去氯化氢,再通过浓硫酸吸收水蒸气得到干燥氯气,洗气装置导气管是长进短出;收集气体需要用向上排气法收集,导气管长进短出;连接顺序是a、e、d、b、c、g、f;故答案为:a、e、d、b、c、g、f;
③氯气有毒污染空气,需要在装置的最后连接装有氢氧化钠溶液的尾气吸收装置;
故答案为:装置的最后需要连接装有氢氧化钠溶液的尾气吸收装置;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl2;FeCl3和FeCl2;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2;证明假设①正确;
故答案为:溶液变红色;FeCl2;①;
(3)A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,依据沉淀转化原理,反应向更难溶的分析进行,证明Fe(OH)3溶解度小于Mg(OH)2溶解度;故A正确;
B.铁和三价铁之间反应生成亚铁离子,溶液颜色变化为黄色变化为浅绿色;故B错误;
C.三价铁在沸水中水解生成氢氧化铁胶体,故C错误;
D.溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,灼烧得到Fe2O3固体,故D正确,
故答案为:AD.
点评:本题考查物质的性质实验设计,侧重于学生的分析、实验能力的考查,为高考常见题型,题目着重于氯气实验室制备和气体净化实验方法,物质检验实验设计和试剂选择,注意把握实验原理和操作方法,题目难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
两种气态烃以任意比例混合,在105℃时1L该混合烃与3L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是4L.下列各组混合烃中符合此条件的是( )
| A、CH4、C2H4 |
| B、CH4、C3H6 |
| C、C2H4、C3H4 |
| D、C2H2、C3H6 |
不能说明CH3COOH是弱酸的事实是( )
| A、醋酸钠溶液显碱性 |
| B、10mLpH=2的醋酸溶液加水稀释到100mLpH<3 |
| C、中和10mL0.1mol?L-1醋酸溶液,需要消耗0.1mol?L-1氢氧化钠溶液10mL |
| D、0.1 mol?L-1的醋酸溶液中,氢离子浓度约为0.001 mol?L-1 |
在配制一定物质的量浓度的NaOH溶液时,下列仪器肯定不需要的是( )
A、 |
B、 |
C、 |
D、 |