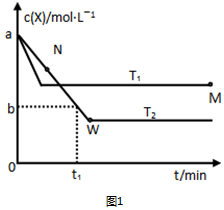
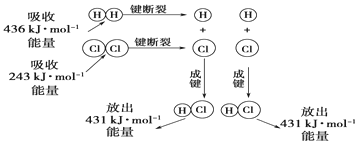
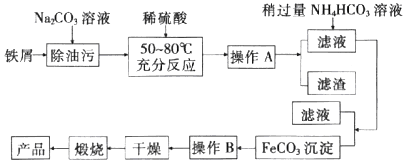
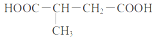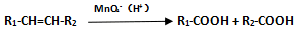题目内容
3.下列说法不正确的是( )| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=4的HCOOH溶液和pH=10的氨水等体积混合;pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定不相等 | |
| C. | 常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 常温下0.lmol/L pH为4的NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
分析 A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进,一水合氨是弱电解质存在电离平衡,铵根离子浓度最小;
B.pH=4的HCOOH溶液和pH=10的氨水等体积混合,水解相互促进,pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合恰好完全反应生成硫酸钠溶液不水解;
C.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后得到等浓度的HB和NaB混合溶液,HB电离程度和B-离子水解程度不确定,不能比较离子浓度大小;
D.常温下0.lmol/L pH为4的NaHA溶液中HA-离子电离程度大于其水解程度.
解答 解:A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进,一水合氨是弱电解质存在电离平衡,铵根离子浓度最小,c(NH4+)由大到小的顺序是:①>③>④>②,故A正确;
B.pH=4的HCOOH溶液和pH=10的氨水等体积混合,水解相互促进,pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合恰好完全反应生成硫酸钠溶液不水解,各混合溶液中由水电离的c(H+)一定不相等,故B正确
C.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后得到等浓度的HB和NaB混合溶液,HB电离程度和B-离子水解程度不确定,不能比较离子浓度大小,故C错误;
D.常温下0.lmol/L pH为4的NaHA溶液中HA-离子电离程度大于其水解程度,溶液中离子浓度大小c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故D正确
故选C.
点评 本题考查了盐类水解、酸碱反应后溶液酸碱性比较、离子浓度大小判断、弱电解质电离平衡影响因素等,掌握基础是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案①向碘水中加入CCl4后振荡、静置②二氧化氮经加压凝成无色液体③石蜡催化裂化④碘受热后变成碘蒸气⑤照片底片被感光⑥煤的干馏( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
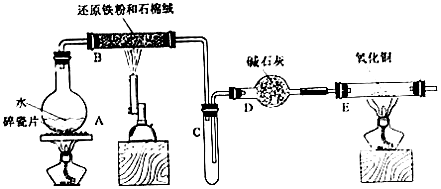
(1)烧瓶底部放置了几片碎瓷片,碎资片的作用是防暴沸.装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4H2+Fe3O4.
(2)如果要在E处玻璃管处点燃该气体,则必须对该气体进行验纯装置中的现象是黑色变为紫红色,试管口有水珠生成..
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Cl2+2Fe2+=2Fe3++2Cl-,Fe3++SCN-=FeSCN2+;溶液褪色可能的原因是氯水将SCN-氧化破坏了;验证方法为继续向溶液中滴入KSCN溶液,溶液变红即可证明.
(4)其中一组同学将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL.5mol•L-1FeSO4溶液和5.2g固体沉淀物,则原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L;将沉淀物过滤后,该组同学又向清液中滴加稀硝酸,观察到有NO气体生成,发生的化学反应方程式为6FeSO4+8HNO3=2Fe2(SO4)3+2NO↑+4H2O+2Fe(NO3)3.