题目内容
11.对下列物质的用途解释正确的是( )| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
分析 A.过氧化钠与二氧化碳、水的反应中,自身发生氧化还原反应;
B.FeCl3与铜单质反应生成氯化亚铁、氯化铜;
C.氧化铝熔点高,难高温;
D.氨常用作制冷剂与易液化有关.
解答 解:A.过氧化钠与二氧化碳、水的反应中,自身发生氧化还原反应,二氧化碳、水既不是氧化剂也不是还原剂,故A错误;
B.FeCl3与铜单质反应生成氯化亚铁、氯化铜,没有单质生成,不是置换反应,故B错误;
C.氧化铝熔点高,难高温,可用于耐火材料,故C正确;
D.氨易液化,由液体变为气体吸热,可用作制冷剂,与沸点有关,为物理性质,故D错误.
故选C.
点评 本题综合考查物质的性质以及应用,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学史素养,提高学习的积极性,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.硝基苯是医药和染料的中间体,还是有机溶剂.反应流程、装置如下.

制备硝基苯时还可能发生下列副反应:

有关数据如下表
(1)制备硝基苯的反应式C6H6+HNO3$→_{50-60℃}^{浓硫酸}$C6H5NO2+H2O;
(2)步骤①配置混酸:取100 mL烧杯,用20mL浓硫酸与18mL浓硝酸配置混合酸,操作是:在烧杯中先加入18mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混合酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(3)在室温下向三颈瓶中的苯中逐滴加入混酸,边滴边搅拌,混合均匀、加热.上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是减少(或防止)副反应发生或减少硝酸分解.
硝基苯的提纯步骤为:

(4)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(5)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(6)设计实验证明“粗产品2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(7)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示)反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.

制备硝基苯时还可能发生下列副反应:

有关数据如下表
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶 |
(2)步骤①配置混酸:取100 mL烧杯,用20mL浓硫酸与18mL浓硝酸配置混合酸,操作是:在烧杯中先加入18mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却;把配好的混合酸加入恒压漏斗中;最后在三颈烧瓶中加入18mL苯.
(3)在室温下向三颈瓶中的苯中逐滴加入混酸,边滴边搅拌,混合均匀、加热.上图中的加热方式称为水浴加热;反应温度控制在50~60℃的原因是减少(或防止)副反应发生或减少硝酸分解.
硝基苯的提纯步骤为:

(4)步骤⑤表明混合物中有苯和硝基苯的操作和现象是混合物倒入蒸馏水中,液体分为三层.
(5)验证步骤⑥中液体已洗净的操作和现象是:取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;为了得到更纯净的硝基苯,还须向液体中加入无水CaCl2除去水,然后蒸馏(填操作名称).
(6)设计实验证明“粗产品2”中含二硝基苯测定粗产品的密度大于1.205g•cm-3.
(7)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示)反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
2.在恒容密闭容器中发生下列反应C(s)+CO2(g)?2CO(g)△H>0下列有关该反应描述正确的是( )
| A. | 容器内气体的压强不再变化时,反应一定处于平衡状态 | |
| B. | 降低c(CO)和增加C(s)均可以使平衡向正反应方向移动 | |
| C. | 其他条件一定时,升高温度和减小压强均可使CO2的转化率降低 | |
| D. | 在一定条件下,CO2的生成速率等于CO的生成速率时,反应一定处于平衡状态 |
19.下列有关溶液组成的描述合理的是( )
| A. | 澄清透明溶液中可能大量存在:Cu2+、Mg2+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液中可能大量存在:K+、NH4+、Cl-、I- | |
| C. | 加入A1能放出大人量H2的溶液中可能大量存在:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液中可能大量存在:K+、AlO2-、CO32-、Na+ |
6.下列有关化学用语表示正确的是( )
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: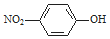 | D. | H2S的电子式: |
3.下列说法不正确的是( )
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=4的HCOOH溶液和pH=10的氨水等体积混合;pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定不相等 | |
| C. | 常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 常温下0.lmol/L pH为4的NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
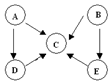 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.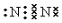 ,D的结构式:
,D的结构式: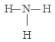 .
. 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害. ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
 ⑧
⑧ ⑨
⑨ ⑩
⑩