题目内容
8.用质谱法分析得知某链状烯烃的相对分子质量为124.用酸性KMnO4溶液氧化,得到两种产物:a.CH3COOH,b.
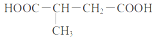
(1)a的名称为乙酸.
(2)写出该烃可能的结构简式CH3CH=CHCH(CH3)CH2CH=CHCH3.
分析 用酸性KMnO4溶液氧化,得到两种产物,由b可知烃中含有2个碳碳双键,结合相对分子质量可知烃应为CH3CH=CHCH(CH3)CH2CH=CHCH3,以此解答该题.
解答 解:(1)CH3COOH为乙酸的结构简式,故答案为:乙酸;
(2)由以上分析可知该烃的结构简式为CH3CH=CHCH(CH3)CH2CH=CHCH3,故答案为:CH3CH=CHCH(CH3)CH2CH=CHCH3.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握烯烃与高锰酸钾发生氧化反应的性质,由双键的变化判断烃的种类,难度不大.

练习册系列答案
相关题目
19.下列有关溶液组成的描述合理的是( )
| A. | 澄清透明溶液中可能大量存在:Cu2+、Mg2+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液中可能大量存在:K+、NH4+、Cl-、I- | |
| C. | 加入A1能放出大人量H2的溶液中可能大量存在:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液中可能大量存在:K+、AlO2-、CO32-、Na+ |
3.下列说法不正确的是( )
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=4的HCOOH溶液和pH=10的氨水等体积混合;pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定不相等 | |
| C. | 常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 常温下0.lmol/L pH为4的NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
13.下列离子方程式书写不正确的是( )
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时:4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B. | 向含1mol的NaOH溶液中通入1mol的H2S气体:H2S+2OH-=S2-+2H2O | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
17.一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为99.2g,当其缓慢经过无水CaCl2时,CaCl2增重50.4g.原混合气体中CO2的质量为( )
| A. | 13.2 g | B. | 22.4g | C. | 24.4g | D. | 26.4g |
5.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol氦气中有2NA个氦原子 | |
| B. | 14 g氮气中含6.02×1023个氮原子 | |
| C. | 2 L 0.3 mol•L-1 Na2SO4溶液中含0.6 NA个Na+ | |
| D. | 18 g水中所含的电子数为10NA |
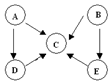 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.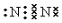 ,D的结构式:
,D的结构式: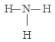 .
.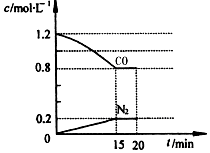 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.