题目内容
14.物质的化学变化乍看起来,好像十分复杂,难以把握,而实际上是有规律可循的.认识化学原理并将化学原理应用于实际正是化学的魅力所在.I.在恒容密闭容器中通入X并发生反应:
2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图1所示:
①该反应的化学平衡常数表达式为:$\frac{c(Y)}{{c}^{2}(X)}$
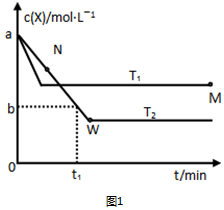
②M点的正反应速率v正>(填“>”、“=”或“<”)N点的逆反应速率v逆;T2下,在0~t1时间内,v(Y)=$\frac{2(a-b)}{{t}_{1}}$mol•L-1•min-1 ;该反应进行到M点放出的热量<(填“>”、“=”或“<”)进行到W点放出的热量.
③M点时再加入一定量的X,平衡后X的转化率增大(填“增大”、“减小”或“不变”)

II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(OH-)>c(H+),
III.图2是某种燃料电池原理示意图.
(1)该燃料电池工作过程中,其正极反应式为:O2+4H++4e-=2H2O
(2)若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的a极(图3)(填“a”或“b”)上.若用此燃料电池电解精炼银,应使粗银作电解池的阳极,使用AgNO3和HNO3的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为:2H++NO3-+e-=NO2↑+H2O.
分析 Ⅰ.由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②温度高,反应速率快;结合v=$\frac{△c}{△t}$计算;该反应为放热反应,M点转化率小;
③M点时再加入一定量X,平衡正向移动;
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合发生反应为:NaHCO3+NaOH=Na2CO3+H2O,得到溶液为碳酸钠溶液,碳酸根离子分步水解溶液显碱性;
III.(1)该装置为氢氧燃料酸性电池,燃料电池中,通入燃料的电极为负极,通入氧化剂的电极为正极,原电池放电时,电解质溶液中阳离子向正极移动,正极上氧气得电子和氢离子反应生成水;
(2)电镀时,镀层作阳极,镀件作阴极;电解精炼时,粗银作阳极,纯银作阴极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮.
解答 解:Ⅰ.由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量浓度越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应,
①2X(g)?Y(g),平衡常数K=$\frac{c(Y)}{{c}^{2}(X)}$,故答案为:$\frac{c(Y)}{{c}^{2}(X)}$;
②温度高,反应速率快,则M点的正反应速率>N点的逆反应速率,T2下,在0~t1时间内,v(X)=$\frac{a-b}{{t}_{1}}$mol•L-1•min-1,由速率之比等于化学计量数之比可知v(Y)=$\frac{2(a-b)}{{t}_{1}}$mol•L-1•min-1,由于正向是放热反应,低温利用平衡正向移动,则进行到M点X的转化率较低,所以反应进行到M点放出的热量少,该反应进行到M点放出的热量<进行到W点放出的热量,
故答案为:>;$\frac{2(a-b)}{{t}_{1}}$mol•L-1•min-1;<;
③M点时再加入一定量X,平衡正向移动,该反应中反应物、生成物均只有一种,则平衡后X的转化率增大,
故答案为:增大;
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合发生反应为:NaHCO3+NaOH=Na2CO3+H2O,得到溶液为碳酸钠溶液,碳酸根离子分步水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(OH-)>c(H+);
III.(1)该装置为氢氧燃料酸性电池,燃料电池中,通入燃料的电极为负极,通入氧化剂的电极为正极,原电池放电时,电解质溶液中氢离子向正极b移动,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(2)电镀时,镀层作阳极,镀件作阴极,所以铁上镀铜时,铁作阴极,连接原电池的负极a;电解精炼时,粗银作阳极,纯银作阴极,所以粗银作阳极,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3-+e-=NO2↑+H2O,
故答案为:a;阳;2H++NO3-+e-=NO2↑+H2O.
点评 本题考查了化学平衡的计算、图象理解应用、电解质溶液中离子浓度大小比较、盐类水解原理、原电池和电解池原理、物质的量的计算、电极反应式的书写,根据串联电路中转移电子相等计算空气的体积,注意书写电极反应式时要结合电解质溶液的酸碱性,把握温度的比较、平衡移动及速率计算为解答的关键,侧重分析与应用能力的考查,注意图象的应用,题目难度中等.

(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_赶走水中的溶解氧(或空气)_.
(2)用该方法获得的Na2S2O3•5H2O晶体中常混有一定量的杂质.某兴趣小组欲对其中所含杂质的成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】假设1:晶体中只含Na2CO3杂质; 假设2:晶体中只含Na2S杂质;
假设3:晶体中含Na2S和Na2CO3两种杂质.
【查阅资料】①SO2+2H2S═3S↓+2H2O;
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.
③H2S+CuSO4═CuS↓(黑色)+H2SO4
【判断与思考】某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?不合理(填“合理”或“不合理”),请说明理由:Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出.
【设计方案进行实验】基于假设1,完成下表中的实验方案、现象及结论(仪器自选).限选实验试剂:3mol•L-1 H2SO4溶液、1mol•L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水.
| 实验方案 | 现象及结论 |
| A. | 容器内气体的压强不再变化时,反应一定处于平衡状态 | |
| B. | 降低c(CO)和增加C(s)均可以使平衡向正反应方向移动 | |
| C. | 其他条件一定时,升高温度和减小压强均可使CO2的转化率降低 | |
| D. | 在一定条件下,CO2的生成速率等于CO的生成速率时,反应一定处于平衡状态 |
| A. | 澄清透明溶液中可能大量存在:Cu2+、Mg2+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液中可能大量存在:K+、NH4+、Cl-、I- | |
| C. | 加入A1能放出大人量H2的溶液中可能大量存在:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液中可能大量存在:K+、AlO2-、CO32-、Na+ |
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: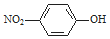 | D. | H2S的电子式: |
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=4的HCOOH溶液和pH=10的氨水等体积混合;pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定不相等 | |
| C. | 常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 常温下0.lmol/L pH为4的NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
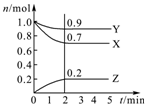 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得: )和抗癫痫药物
)和抗癫痫药物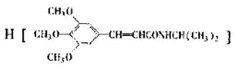 的路线如下(部分反应条件和试剂略去)
的路线如下(部分反应条件和试剂略去)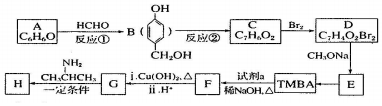
 +H2O(R、R′表示烃基或氢原子)
+H2O(R、R′表示烃基或氢原子)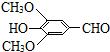 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→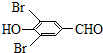 +2HBr.
+2HBr.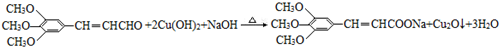 .
.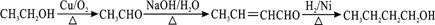 .
.