题目内容
12.铁及其化合物在生产和生活中有着广泛的应用.I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
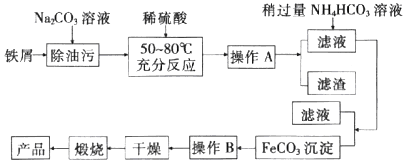
回答下列问题:
(1)操作A、B的名称分别是过滤、洗涤;加入稍过量的NH4HCO3溶液的作用是调节溶液的pH,使溶液中的Fe2+完全沉淀为FeCO3.
(2)写出在空气中充分加热煅烧FeCO3的化学方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质.某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol•L-1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
(3)写出滴定过程中发生反应的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)确定滴定达到终点的操作及现象为向待测液中再滴加一滴标准液时,振荡,溶液刚好由黄色变成浅紫色,且半分钟内不褪去.
(5)上述样品的质量分数为96.4%.
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有bc.
a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗.
分析 铁屑用纯碱溶液洗去油污,加稀硫酸充分反应,经过过滤分离,在滤液中加入碳酸氢铵得到碳酸亚铁,碳酸亚铁,再经过过滤、洗涤,然后再干燥,灼烧得到氧化铁,
(1)分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤;加入稍过量的NH4HCO3溶液沉淀亚铁离子;
(2)FeCO3与氧气反应生成三氧化二铁和二氧化碳;
(3)高锰酸钾离子将亚铁离子氧化为铁离子,自身还原为锰离子;
(4)滴定完成时,亚铁离子反应完全,溶液由黄色变为浅紫色;
(5)根据5FeO~5Fe2+~MnO4-,计算m(FeO),由此计算产品的质量分数;
(6)a.未干澡锥形瓶,不影响滴定结果;
b.盛装标准液的滴定管没有用标准液润洗,则消耗的标准液体积偏大,m(FeO)偏高,Fe2O3的质量分数的测定结果偏低;
c.滴定结束时仰视刻度线读数,则消耗的标准液体积读数偏大,m(FeO)偏高,Fe2O3的质量分数的测定结果偏低;
d.量取待测液的滴定管没有润洗,待测液被稀释,消耗的标准液体积偏小,m(FeO)偏小,Fe2O3的质量分数的测定结果偏高.
解答 解:(l)经过操作A得到滤液滤渣,则操作A为过滤,固体经过操作B后干燥,则为洗涤;加入稍过量的NH4HCO3溶液的作用是调节溶液的pH,使溶液中的Fe2+完全沉淀为FeCO3;
故答案为:过滤;洗涤;调节溶液的pH,使溶液中的Fe2+完全沉淀为FeCO3;
(2)在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,反应方程式为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(3)滴定过程中高锰酸钾离子将亚铁离子氧化为铁离子,自身还原为锰离子,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)滴定完成时,亚铁离子反应完全,溶液由黄色变为浅紫色,则:向待测液中再滴加一滴标准液时,振荡,溶液刚好由黄色变成浅紫色,且半分钟内不褪去,即为滴定终点;
故答案为:向待测液中再滴加一滴标准液时,振荡,溶液刚好由黄色变成浅紫色,且半分钟内不褪去;
(5)根据5FeO~5Fe2+~MnO4-,则m(FeO)=0.01mol/L×0.02L×5×$\frac{100mL}{25mL}$×72g/mol=0.288g,则m(Fe2O3)=8g-0.288g=7.712g,样品质量分数为:$\frac{7.712g}{8g}×100%$=96.4%;
故答案为:96.4%;
(6)a.未干澡锥形瓶,不影响滴定结果,错误;
b.盛装标准液的滴定管没有用标准液润洗,则消耗的标准液体积偏大,m(FeO)偏高,Fe2O3的质量分数的测定结果偏低,正确;
c.滴定结束时仰视刻度线读数,则消耗的标准液体积读数偏大,m(FeO)偏高,Fe2O3的质量分数的测定结果偏低,正确;
d.量取待测液的滴定管没有润洗,待测液被稀释,消耗的标准液体积偏小,m(FeO)偏小,Fe2O3的质量分数的测定结果偏高,错误;
故答案为:b、c.
点评 本题考查了铁的化合物的性质及其应用,题目难度中等,涉及净水原理、化学实验基本操作方法的应用、离子方程式书写、氧化还原滴定等知识,试题知识点较多,充分考查学生的分析能力及化学实验、化学计算能力.

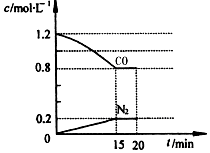
| A. | 容器内气体的压强不再变化时,反应一定处于平衡状态 | |
| B. | 降低c(CO)和增加C(s)均可以使平衡向正反应方向移动 | |
| C. | 其他条件一定时,升高温度和减小压强均可使CO2的转化率降低 | |
| D. | 在一定条件下,CO2的生成速率等于CO的生成速率时,反应一定处于平衡状态 |
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3•H2O ③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② | |
| B. | 常温时,pH=4的HCOOH溶液和pH=10的氨水等体积混合;pH=4的H2SO4溶液和pH=10的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定不相等 | |
| C. | 常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 常温下0.lmol/L pH为4的NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
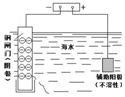
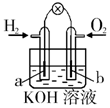
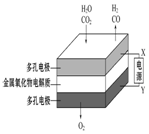
| A | B | C | D |
| 钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH--4e-=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 后,乙池溶液的总质量增加 |
 |  |  | 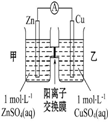 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 13.2 g | B. | 22.4g | C. | 24.4g | D. | 26.4g |
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 | |
| C. | 工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 | |
| D. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害. )和抗癫痫药物
)和抗癫痫药物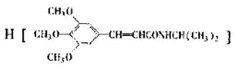 的路线如下(部分反应条件和试剂略去)
的路线如下(部分反应条件和试剂略去)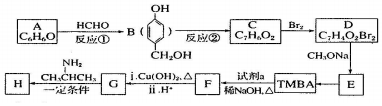
 +H2O(R、R′表示烃基或氢原子)
+H2O(R、R′表示烃基或氢原子)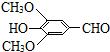 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O. +2Br2→
+2Br2→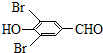 +2HBr.
+2HBr.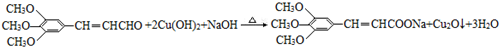 .
.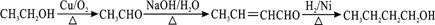 .
. ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
 ⑧
⑧ ⑨
⑨ ⑩
⑩