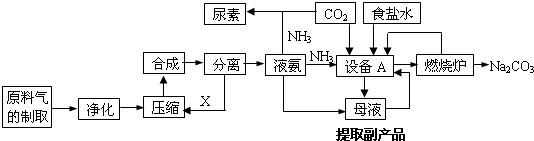
题目内容
19.下列物质的转化在给定条件下能实现的是( )①SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl溶液}{→}$H2SiO3
②Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3
③BaSO4$\stackrel{饱和Na_{2}CO_{3}溶液}{→}$BaCO3$\stackrel{HCl溶液}{→}$BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
④AlCl3溶液$\stackrel{电解}{→}$Al$\stackrel{NaOH}{→}$NaAlO2
⑤HCHO$→_{催化剂、△}^{O_{2}}$HCOOH$→_{H_{2}SO_{4}、△}^{CH_{3}OH}$HCOOCH3.
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
分析 ①二氧化硅能够与氢氧化钠溶液反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸;
②铁燃烧生成四氧化生铁,无法得到氧化铁;
③只要溶液中c(Ba2+)•c(CO32-)>Ksp(BaCO3)即可形成碳酸钡沉淀;
④电解氯化铝溶液生成氯气、氢气和氢氧化铝;
⑤甲醛催化氧化生成甲酸,甲酸与甲醇可以发生反应生成甲酸甲酯.
解答 解:①二氧化硅能够与氢氧化钠溶液反应生成硅酸钠,硅酸钠与盐酸反应生成硅酸,可以转化关系SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl溶液}{→}$H2SiO3可以实现,故①正确;
②铁燃烧生成四氧化生铁,得不到氧化铁,故②错误;
③只要溶液中c(Ba2+)•c(CO32-)>Ksp(BaCO3)即可形成碳酸钡沉淀,因此硫酸钡能溶于饱和的碳酸钠溶液中生成碳酸钡,故③正确;
④电解氯化铝溶液生成氯气、氢气和氢氧化铝,无法得到金属铝,故④错误;
⑤甲醛催化氧化生成甲酸,甲酸与甲醇可以发生反应生成甲酸甲酯,该转化关系HCHO$→_{催化剂、△}^{O_{2}}$HCOOH$→_{H_{2}SO_{4}、△}^{CH_{3}OH}$HCOOCH3可以实现,故⑤正确,
答案选D.
点评 本题考查了常见元素单质及其化合物性质,题目难度中等,明确常见元素及其化合物性质为解答关键,试题有利于培养学生的分析、理解能力及灵活应用能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
9.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 所用NaOH已吸潮 | B. | NaOH溶解后立即转移到容量瓶中 | ||
| C. | 有少量NaOH溶液残留在烧杯内 | D. | 向容量瓶加水时眼睛一直仰视液面 |
7.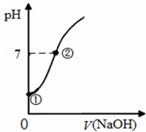 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在次氯酸的电离平衡 | |
| B. | ②点所示溶液中:c(Na+)═c(Cl-)+c(ClO-) | |
| C. | I-能在②所示溶液中存在 | |
| D. | ①到②水的电离程度逐渐减小 |
11.下列各组顺序的排列不正确的是 ( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 热稳定性H2O>H2Se>H2S |
8.几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )
| 元素代号 | 原子半径/nm | 主要化合价 |
| X | 0.160 | +2 |
| Y | 0.143 | +3 |
| Z | 0.102 | +6、-2 |
| L | 0.099 | +7、-1 |
| M | 0.077 | +4、-4 |
| Q | 0.074 | -2 |
| A. | Z的氢化物的稳定性强于L的氢化物的稳定性 | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多 | |
| D. | 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键 |
9.用下列实验装置进行相应实验,能达到实验目的是( )
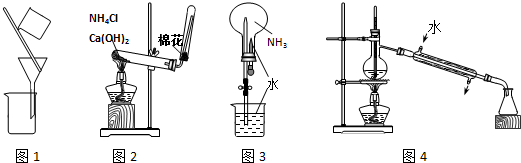

| A. | 用图1装置分离乙醇和乙酸 | B. | 用图2装置制取氨气 | ||
| C. | 用图3装置进行氨气的喷泉实验 | D. | 用图4装置进行石油的分馏实验 |
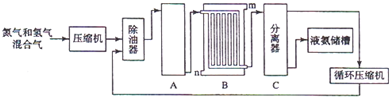
 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO;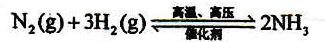 ;
;