题目内容
15.下列各组元素性质或原子结构的递变,叙述不正确的是( )| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | N、O、F得电子能力依次减弱 | |
| D. | LiOH、NaOH、KOH的碱性逐渐增强 |
分析 A.同周期从左向右最外层电子数增多;
B.第三周期从左向右最高正价增大;
C.同周期从左向右非金属性增强,得到电子能力增强;
D.金属性越强,对应碱的碱性越强.
解答 解:A.同周期从左向右最外层电子数增多,则Na、Mg、Al原子最外层电子数依次增多,故A正确;
B.第三周期从左向右最高正价增大,则P、S、Cl元素最高正化合价依次增大,故B正确;
C.同周期从左向右非金属性增强,得到电子能力增强,则N、O、F得电子能力依次增强,故C错误;
D.金属性K>Na>Li,则LiOH、NaOH、KOH的碱性逐渐增强,故D正确;
故选C.
点评 本题考查周期表和周期律的应用,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
5.下列有关概念说法正确的是( )
| A. | D2、T2、H2互为同素异形体 | B. | 石墨、金刚石互为同位素 | ||
| C. | 甲烷和异丁烷互为同系物 | D. | 乙烷和乙烯互为同分异构体 |
6.某化学研究性学习小组对铜及铜的部分化合物的性质进行实验探究,研究的问题和过程如下:
Ⅰ.氯化铜的制备
该研究性小组在实验室里用如表仪器和药品来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号,用①、②等序号填写):③接⑤接④接②接①接⑥.
(2)装置④的作用是除去氯气中混杂的氯化氢气体;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为4NaCl+4H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4NaHSO4+Cl2↑+2H2O
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验Ⅰ中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的氯化铜溶液外,还需要一定选用的试剂为bc (填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更稳定 (填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为Cu2O+2H+=H2O+Cu2++Cu.
Ⅰ.氯化铜的制备
该研究性小组在实验室里用如表仪器和药品来制取纯净的无水氯化铜:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 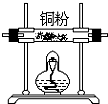 | 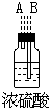 | 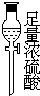 | 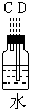 | 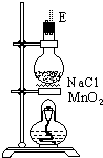 | 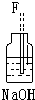 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号,用①、②等序号填写):③接⑤接④接②接①接⑥.
(2)装置④的作用是除去氯气中混杂的氯化氢气体;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为4NaCl+4H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4NaHSO4+Cl2↑+2H2O
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验Ⅰ中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的氯化铜溶液外,还需要一定选用的试剂为bc (填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更稳定 (填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为Cu2O+2H+=H2O+Cu2++Cu.
10.苯的结构式可用来 表示,下列关于苯的叙述中不正确的是( )
表示,下列关于苯的叙述中不正确的是( )
 表示,下列关于苯的叙述中不正确的是( )
表示,下列关于苯的叙述中不正确的是( )| A. | 苯在空气中燃烧会产生大量黑烟 | |
| B. | 苯环的结构中不存在双键,但能与氢气发生加成反应 | |
| C. | 苯和乙烯均可使溴水褪色,且其褪色原理相同 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
7.常温下在①pH=3的NH4Cl溶液;②pH=3的硫酸溶液;③pH=11的Na2CO3溶液中,水电离出的H+浓度之比是( )
| A. | 108:1:108 | B. | 1:1:108 | C. | 1:108:1 | D. | 1:108:108 |
4.某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性分别为3.44和3.98,已知AB2分子的键角为103.3°.下列推断不正确的是( )
| A. | AB2分子的空间构型为V形 | |
| B. | AB2与H2O相比,AB2的熔、沸点比H2O的低 | |
| C. | AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 | |
| D. | A-B键为极性共价键,AB2分子为非极性分子 |
5.甲苯的二氯代物的结构有( )
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |
 医药阿斯匹林的结构简式如图1所示:试根据阿斯匹林的结构回答;
医药阿斯匹林的结构简式如图1所示:试根据阿斯匹林的结构回答; (任写一种)
(任写一种) .
. .
. 坩埚;
坩埚; 泥三角.
泥三角.