题目内容
7.常温下在①pH=3的NH4Cl溶液;②pH=3的硫酸溶液;③pH=11的Na2CO3溶液中,水电离出的H+浓度之比是( )| A. | 108:1:108 | B. | 1:1:108 | C. | 1:108:1 | D. | 1:108:108 |
分析 常温下电解质溶液中存在离子积常数Kw=c(H+)c(OH-)=10-14,水电离出的H+浓度和水电离出的氢氧根离子浓度相同,据此计算水电离出的氢离子浓度之比.
解答 解:常温下在①pH=3的NH4Cl溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,水电离出的H+浓度为10-3mol/L;
②pH=3的硫酸溶液中水电离出的氢氧根离子浓度等于氢离子浓度=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L;
③pH=11的Na2CO3溶液中,碳酸根离子水解溶液显碱性,CO32-+H2O?HCO3-+OH-,水电离出氢离子浓度等于氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,
水电离出的H+浓度之比=10-3mol/L:10-11mol/L:10-3mol/L=108:1:108,
故选A.
点评 本题考查了水的电离及其影响因素、弱电解质的电离平衡、水解平衡等知识,题目难度中等,试题涉及的题量较大,充分考查了学生对所学知识的掌握情况,明确溶液中水电离的氢离子浓度大小的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列说法正确的是( )
| A. | 可用溴水鉴别直馏汽油和裂化汽油 | |
| B. | “乙醇汽油”是在汽油里加入适量乙醇而形成的一种燃料,它是一种新型化合物 | |
| C. | 煤的干馏和石油的分馏都是物理变化 | |
| D. | 石油分馏获得的石油气中,含甲烷、乙烷、乙烯等气态烃 |
15.下列各组元素性质或原子结构的递变,叙述不正确的是( )
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | N、O、F得电子能力依次减弱 | |
| D. | LiOH、NaOH、KOH的碱性逐渐增强 |
2.下列数据记录合理的是( )
| A. | 用托盘天平称取8.75 g食盐 | |
| B. | 用25 mL量筒量取12.36 mL盐酸 | |
| C. | 用广泛pH试纸测得某溶液pH值为3.5 | |
| D. | 用碱式滴定管移取NaOH溶液23.10 mL |
12.化学与生活密切相关,下列有关说法错误的是( )
| A. | 在人体内,油脂在脂肪酶催化作用下水解为高级脂肪酸和甘油 | |
| B. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
17.下列有关物质的应用说法正确的是( )
| A. | 可以用铝制槽罐车运输浓硫酸 | |
| B. | 亚硝酸盐可以防腐,所以在食品中可以广泛使用 | |
| C. | 洁厕灵和漂白粉都具有去污作用,一同使用效果会更好 | |
| D. | 治疗胃酸过多可以使用碳酸钠 |
 试回答下列问题:
试回答下列问题: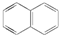 .萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.
.萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.
 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.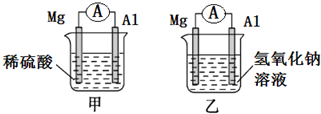 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.