题目内容
6.某化学研究性学习小组对铜及铜的部分化合物的性质进行实验探究,研究的问题和过程如下:Ⅰ.氯化铜的制备
该研究性小组在实验室里用如表仪器和药品来制取纯净的无水氯化铜:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 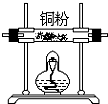 | 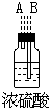 | 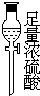 | 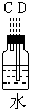 | 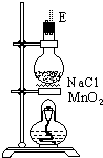 | 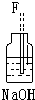 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号,用①、②等序号填写):③接⑤接④接②接①接⑥.
(2)装置④的作用是除去氯气中混杂的氯化氢气体;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为4NaCl+4H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4NaHSO4+Cl2↑+2H2O
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验Ⅰ中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的氯化铜溶液外,还需要一定选用的试剂为bc (填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更稳定 (填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为Cu2O+2H+=H2O+Cu2++Cu.
分析 (1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓硫酸与氯化钠、二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,据此答题;
(2)氯气中的杂质气体氯化氢需要除去,氯化氢极易溶于水,氯气可溶于水;
(3)浓硫酸与氯化钠、二氧化锰加热反生成氯气、氯化锰、硫酸氢钠和水,依据原子守恒和电子守恒配平书写化学方程式;
(4)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,两性氢氧化物是指和酸、碱都反应的氢氧化物,根据提供的药品可确定还需要的药品;
(5)根据在不同温度下反应物的组成可确定物质的稳定性;
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,是氧化亚铜在酸溶液中发生歧化反应上层硫酸铜和铜;
解答 解:(1)根据题中实验原理,用③中浓硫酸与⑤中氯化钠、二氧化锰加热反生成氯气,通过④中水除去氯气中的氯化氢,除杂后通过②中浓硫酸干燥后,通过①加热与铜反应生成氯化铜,剩余氯气进行尾气吸收,尾气用⑥中氢氧化钠吸收,所以仪器连接顺序为:③⑤④②①⑥,
故答案为:③⑤④②①⑥;
(2)装置⑤中氯化钠和浓硫酸、二氧化锰混合加热反应生成氯气中会混有氯化氢杂质气体,通过装置④中水除去氯气中的氯化氢,
故答案为:除去氯气中混杂的氯化氢气体;
(3)浓硫酸与氯化钠、二氧化锰加热反生成氯气、氯化锰、硫酸氢钠和水,反应的化学方程式为:4NaCl+4 H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4 NaHSO4+Cl2↑+2H2O,
故答案为:4NaCl+4 H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4 NaHSO4+Cl2↑+2H2O;
(4)要证明Cu(OH)2具有两性,应先在氯化铜溶液中加入氢氧化钠溶液生成Cu(OH)2,上层的氢氧化铜沉淀中 分别加入酸和碱验证是否溶解,来证明氢氧化铜是否具有两性,所以需要试剂为氢氧化钠溶液,稀硫酸,
故答案为:bc;
(5)氢氧化铜沉淀制得氧化铜粉末,继续加热到1000℃以上,黑色粉末全部变成红色Cu2O粉末,说明在较高温度时Cu2O稳定,+l价的Cu比+2价Cu更稳定,
故答案为:稳定;
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,是氧化亚铜在酸溶液中发生歧化反应上层硫酸铜和铜,反应的离子方程式为:Cu2O+2H+=H2O+Cu2++Cu
故答案为:Cu2O+2H+=H2O+Cu2++Cu.
点评 本题考查了常见气体的制取和收集及实验的注意事项,氯化铜的性质和制取,主要是掌握其选择的依据及原理、验证两性氢氧化物的方法和铜的化合物性质对比,掌握基础是解题关键,题目难度中等,

| A. | 原混合气体中O2和CH4的体积比为2:1 | |
| B. | 残留物中只有Na2CO3 | |
| C. | 原混合气体中O2和CH4的物质的量之比为1:2 | |
| D. | 残留物只有Na2CO3和NaOH |
| A. | 氧化性 | B. | 还原性 | C. | 漂白性 | D. | 酸性 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 铅蓄电池 | B. | 锌锰电池 | C. | 镍镉电池 | D. | 甲烷燃料电池 |
| A. | 可用溴水鉴别直馏汽油和裂化汽油 | |
| B. | “乙醇汽油”是在汽油里加入适量乙醇而形成的一种燃料,它是一种新型化合物 | |
| C. | 煤的干馏和石油的分馏都是物理变化 | |
| D. | 石油分馏获得的石油气中,含甲烷、乙烷、乙烯等气态烃 |
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增大 | |
| C. | N、O、F得电子能力依次减弱 | |
| D. | LiOH、NaOH、KOH的碱性逐渐增强 |
 试回答下列问题:
试回答下列问题: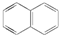 .萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.
.萘的一氯代物有2种可能的结构,萘的六氯代物有10种可能的结构.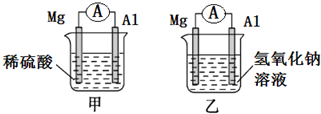 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.