题目内容
13.下列物质中能使酸性KMnO4溶液褪色的是( )①乙烯 ②苯 ③乙醇 ④甲烷 ⑤乙酸 ⑥二氧化硫.
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ②④⑤⑥ |
分析 根据烯烃、炔烃、苯的同系物、醇、酚、醛、SO2都能与酸性KMnO4溶液发生氧化还原反应而褪色分析.
解答 解:①乙烯含有碳碳双键,能被酸性高锰酸钾溶液氧化;
②苯性质稳定,不能被酸性高锰酸钾溶液氧化;
③乙醇中羟基能被酸性高锰酸钾氧化成羧基;
④甲烷性质稳定,不能被酸性高锰酸钾溶液氧化;
⑤乙酸不能被酸性高锰酸钾溶液氧化;
⑥SO2具有较强的还原性,能被酸性高锰酸钾溶液氧化;
因此能被酸性高锰酸钾溶液氧化的是①③⑥,
故选B.
点评 本题综合考查有机物的性质,注意把握有机物的结构和官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
3.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白.
(1)①②⑥⑦中原子半径最小的是N(填元素符号);
(2)表中氧化性最强的单质的化学式为F2;
(3)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(4)写出由⑤形成的单质Ne(填化学式符号);
(5)表中能形成两性氢氧化物的元素是Al(填元素符号).
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
(2)表中氧化性最强的单质的化学式为F2;
(3)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(4)写出由⑤形成的单质Ne(填化学式符号);
(5)表中能形成两性氢氧化物的元素是Al(填元素符号).
4.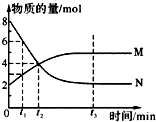 在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
 在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为:2M?N | B. | t2时,正逆反应速率相等 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,N的浓度是M浓度的2倍 |
8.a、b、c、d、e是同一周期的五种主族元素,a和b的最高价氧化物对应的水化物均呈碱性,且碱性b>a,c和d的气态氢化物的稳定性c>d;e是这五种元素中离子半径最小的元素,则它们的原子序数由小到大的顺序是( )
| A. | b、a、d、c、e | B. | e、b、a、d、c | C. | c、b、e、a、b | D. | b、a、e、d、c |
5.最近美国宇航局(NASA)马里诺娃博士找到了一种比CO2有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”,使火星成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的结构式为 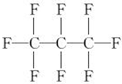 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中只有极性键 |
2.含有共价键的离子化合物是( )
| A. | KCl | B. | HF | C. | NaOH | D. | CaCl2 |
3.W是由短周期元素X、Y、Z组成的盐.X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期.下列说法一定正确的是( )
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | W晶体中只存在有共价键 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
 ; ②Cl2
; ②Cl2 ;③CO2
;③CO2 .
.