题目内容
明矾石的主要成分是K2SO4?Al2(SO4)3?2Al2O3?6H2O,此外还含有少量Fe2O3杂质.利用明矾石制备氢氧化铝的流程如下:
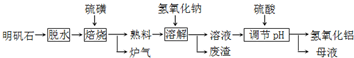
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+ ;该反应的氧化剂是 ;该反应中被氧化的元素与被还原的元素的质量比是 .
(2)“溶解”时反应的离子方程式为 .
(3)“调节pH后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是 .
(4)“母液”中可回收的物质是 .
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式为 .

(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S
| ||
(2)“溶解”时反应的离子方程式为
(3)“调节pH后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
(4)“母液”中可回收的物质是
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:根据元素守恒和得失电子守恒,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质.
(1)所含元素化合价降低的反应物是氧化剂;根据得失电子守恒计算;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)“母液”中含有硫酸盐;
(5)氢氧化铝脱水生成氧化铝,电解熔融的氧化铝得到Al和氧气.
| ||
(1)所含元素化合价降低的反应物是氧化剂;根据得失电子守恒计算;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)“母液”中含有硫酸盐;
(5)氢氧化铝脱水生成氧化铝,电解熔融的氧化铝得到Al和氧气.
解答:
解:根据元素守恒和得失电子守恒,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,
氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质
(1)反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S
2Al2O3+9SO2,Al2(SO4)3化合价降低得电子为氧化剂,反应中失电子被氧化的S为3mol,则得电子被还原的S为6mol,所以该反应中被氧化的元素与被还原的元素的质量比是:1:2;
故答案为:9SO2;Al2(SO4)3;1:2;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,故答案为:K2SO4、Na2SO4;
(5)氢氧化铝脱水生成氧化铝,电解熔融的氧化铝得到Al和氧气,其电解方程式为:2Al2O3(熔融)
4Al+3O2↑;
故答案为:2Al2O3(熔融)
4Al+3O2↑.
| ||
氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质
(1)反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S
| ||
故答案为:9SO2;Al2(SO4)3;1:2;
(2)氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,故答案为:K2SO4、Na2SO4;
(5)氢氧化铝脱水生成氧化铝,电解熔融的氧化铝得到Al和氧气,其电解方程式为:2Al2O3(熔融)
| ||
故答案为:2Al2O3(熔融)
| ||
点评:本题考查物质的制备、分离等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,题目难度中等,注意把握物质的相关性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质属于电解质的是( )
| A、蔗糖 | B、熔融NaOH |
| C、NaCl溶液 | D、铜 |
下列实验装置设计正确,且能达到目的是( )
A、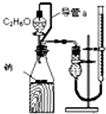 测定乙醇的结构式 |
B、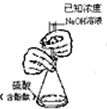 滴定法测定核酸的物质的量浓度 |
C、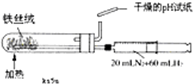 合成氨并检验氨的生成 |
D、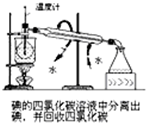 碘的四氯化碳溶液中分离出碘,并回收四氯化碳 |
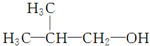 )和甲酸在一定条件下制取E.该反应的化学方程式是
)和甲酸在一定条件下制取E.该反应的化学方程式是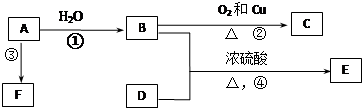 下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:
下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题: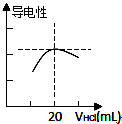 某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下: