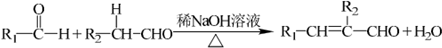
题目内容
下列物质属于电解质的是( )
| A、蔗糖 | B、熔融NaOH |
| C、NaCl溶液 | D、铜 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
单质和混合物不是化合物,既不是电解质也不是非电解质.
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
单质和混合物不是化合物,既不是电解质也不是非电解质.
解答:
解:A、蔗糖在水溶液和熔融态均不能发生电离,以分子形式存在,不导电,因此不是电解质,属于非电解质,故A错误;
B、熔融NaOH是强碱,NaOH在熔融态时发生电离,得到自由移动的钠离子和氢氧根离子,可以导电,属于能够导电的电解质,故B正确;
C、NaCl溶液是混合物,不是化合物,既不是电解质也不是非电解质,故C错误;
D、铜是单质,不是化合物,既不是电解质也不是非电解质,故D错误;
故选B.
B、熔融NaOH是强碱,NaOH在熔融态时发生电离,得到自由移动的钠离子和氢氧根离子,可以导电,属于能够导电的电解质,故B正确;
C、NaCl溶液是混合物,不是化合物,既不是电解质也不是非电解质,故C错误;
D、铜是单质,不是化合物,既不是电解质也不是非电解质,故D错误;
故选B.
点评:本题考查了电解质和非电解质的辨别,难度不大,注意电解质和非电解质的区别在于在一定条件下能否发生电离,单质和混合物不是化合物,既不是电解质也不是非电解质.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列微粒对CH3COO-+H2O?CH3COOH+OH-水解平衡有影响的是( )
| A、H2O |
B、 |
| C、NO3- |
| D、Ba2+ |
常温下,已知某溶液中水电离的c(H+)=10-12 mol/L,那么,该溶液中可能大量共存的离子是( )
| A、Na+、NH4+、Cl-、CH3COO- |
| B、K+、Fe2+、SO42-、NO3- |
| C、Na+、K+、CO32-、ClO- |
| D、Al3+、Cu2+、SO42-、HS- |