题目内容
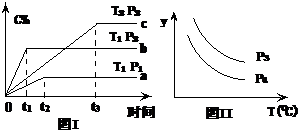 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
考点:化学平衡建立的过程,产物的百分含量随浓度、时间的变化曲线
专题:化学平衡专题
分析:根据图1可知,T1>T2,升高温度,C的含量下降,说明平衡逆向移动,所以该反应正反应为放热反应,P2>P1,增大压强,C的含量增大,平衡正向移动,说明反应是气体体积减小的反应,故X=1,据此结合图2答题.
解答:
解:根据图1可知,T1>T2,升高温度,C的含量下降,说明平衡逆向移动,所以该反应正反应为放热反应,P2>P1,增大压强,C的含量增大,平衡正向移动,说明反应是气体体积减小的反应,故X=1,
A、由于该反应是体积减小的反应,增加压强A的转化率增大,P3线应在下方,故A错误;
B、由于该反应是体积减小的反应,增加压强B的百分含量下降,P3线应在下方,故B错误;
C、由于该反应前后气体质量守恒,容器体积不变,所以密度不变,故C错误;
D、由于该反应是体积减小的反应,增加压强平衡正向移动,总物质的量减小,气体质量守恒,所以平均相对分子质量增大,升高温度,平衡逆向移动,所以平均相对分子质量减小,故D正确;
故选D.
A、由于该反应是体积减小的反应,增加压强A的转化率增大,P3线应在下方,故A错误;
B、由于该反应是体积减小的反应,增加压强B的百分含量下降,P3线应在下方,故B错误;
C、由于该反应前后气体质量守恒,容器体积不变,所以密度不变,故C错误;
D、由于该反应是体积减小的反应,增加压强平衡正向移动,总物质的量减小,气体质量守恒,所以平均相对分子质量增大,升高温度,平衡逆向移动,所以平均相对分子质量减小,故D正确;
故选D.
点评:本题主要考查了平衡移动的影响因素,中等难度,解题的关键在于抓住图象中先拐先平的特点分析问题.

练习册系列答案
相关题目
如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )


| A、500mL 2.0mol?L-1 HCl和500mL 2.0mol?L-1 NaOH的反应符合图1,且△E=57.3kJ |
| B、500mL 2.0mol?L-1 H2SO4和500mL 2.0mol?L-1 Ba(OH)2的反应符合图2,且△E=114.6kJ |
| C、CaO、浓硫酸溶于水时的能量变化符合图1 |
| D、发生图1能量变化的任何反应,一定不需加热即可发生 |
在25℃时.密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、反应可表示为X+3Y?2Z,其平衡常数为1600 |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、反应物和生成物各自具有的总能量决定反应是放热还是吸热 |
| C、任何放热反应在常温条件下一定能发生 |
| D、镁和氧气反应生成氧化镁后,生成物能量明显升高 |

 设计总反应为:2Fe3++Fe═3Fe2+原电池,在框内画出图示.并写出两极反应式.
设计总反应为:2Fe3++Fe═3Fe2+原电池,在框内画出图示.并写出两极反应式.