题目内容
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断△H1 0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为 ,此时的温度为 从上表中选择)
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g)+
O2(g)?CO(g)+2H2O(g)△H=-519kJ?mol-1.工业上,为选择合适的催化剂,分别对X、Y、Z三 种催化剂进行了如下实验(其他条件相同)
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”、“Y”或“Z”)选择的理由是 .
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g)+
| 3 |
| 2 |
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是
考点:化学平衡的影响因素,化学平衡的调控作用
专题:化学平衡专题
分析:(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中;
②依据平衡常数随温度变化分析温度对平衡移动的影响,据此判断;
③利用三段式计算各自组分物质的量变化量、平衡时的物质的量,依据转化率概念计算CO的转化率;根据浓度计算出平衡常数,再判断温度;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低.
②依据平衡常数随温度变化分析温度对平衡移动的影响,据此判断;
③利用三段式计算各自组分物质的量变化量、平衡时的物质的量,依据转化率概念计算CO的转化率;根据浓度计算出平衡常数,再判断温度;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低.
解答:
解:(1)①“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,分析反应可知,反应Ⅰ符合“原子经济”,
故答案为:Ⅰ;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,
故答案为:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)?CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的转化率=
×100%=80%,
此时的平衡常数为:K=
≈2.041,所以温度为250℃,
故答案为:80%;250℃;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低.
故答案为:Ⅰ;
②由表数据可知,温度升高,平衡常数减小,说明平衡逆向进行,逆向是吸热反应,正向放热反应,即△H1<0,
故答案为:<;
③按反应Ⅰ充分反应达到平衡后,测得c(CO)=0.2mol/L,物质的量为0.4mol;
CO (g)+2H2 (g)?CH3OH (g)
起始量(mol) 2 6 0
变化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
CO的转化率=
| 1.6mol |
| 2mol |
此时的平衡常数为:K=
| ||||
|
故答案为:80%;250℃;
(2)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低.
点评:本题考查了化学平衡的有关计算、化学平衡常数及应用、工业生产中条件选择等,难度中等,注意掌握平衡常数应用.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图下列有关说法不正确的( )


| A、反应开始2分钟内,v(B)=0.05mol/(L?min) |
| B、t1时改变的条件可能是减小了反应物的浓度 |
| C、t2时可能升高了温度 |
| D、t3时改变的条件可能是降压,此时c(B)减小 |
水是我们日常生活中最宝贵的资源之一.关于水的叙述正确的是( )
| A、4℃的纯水pH为7 |
| B、水的电离方程式为:H2O?2H++O2- |
| C、重水(D2O)中,质量数是质子数的两倍 |
| D、相同质量的水具有的能量:固体>液体>气体 |
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)?3C(g)+D(g),达到平衡状态的是( )
| A、器内压强不随时间变化而变化 |
| B、反应器内A、B、C、D物质的量比为1:3:3:1 |
| C、生成A的速率和生成的D的速率相等 |
| D、生成 1mol A同时有3 mol C被消耗 |
接触法制硫酸的工业生产中,下列生产操作及原因解释均正确的是( )
| A、硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧 |
| B、SO2氧化为SO3需要高压,可以提高SO2的转化率 |
| C、SO2氧化为SO3需要使用催化剂,可以提高SO2的转化率 |
| D、用98.3%的浓硫酸吸收SO3,可以提高SO3的吸收效率 |
 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
| A、全部 | B、只有①③⑤ |
| C、只有②④⑥ | D、只有①②③④ |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
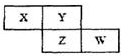 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍