题目内容
在25℃时.密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、反应可表示为X+3Y?2Z,其平衡常数为1600 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A、根据转化率=
×100%计算;
B、根据影响平衡常数的因素判断;
C、根据影响平衡常数的因素判断;
D、根据反应物浓度减小,生成物浓度增加,浓度的变化量之比等于计量数之比,确定化学方程式,根据平衡常数的定义计算平衡常数.
| 转化的浓度 |
| 起始浓度 |
B、根据影响平衡常数的因素判断;
C、根据影响平衡常数的因素判断;
D、根据反应物浓度减小,生成物浓度增加,浓度的变化量之比等于计量数之比,确定化学方程式,根据平衡常数的定义计算平衡常数.
解答:
解:A、根据转化率=
×100%可计算得X的转化率为
×100%=50%,故A正确;
B、对于某个反应来讲,平衡常数只与温度有关,温度改变,平衡常数也改变,故B正确;
C、增大压强,平衡常数不变,故C错误;
D、根据表中数据可知,在反应中X减小0.05mol/L,Y减小0.15mol/L,所以X、Y是反应物,Z增加了0.1mol/L,所以Z是生成物,X、Y、Z的浓度的变化量之比为1:3:2,所以化学方程式为X+3Y?2Z,平衡常数为
=1600,故D正确;
故选C.
| 转化的浓度 |
| 起始浓度 |
| 0.1-0.05 |
| 0.1 |
B、对于某个反应来讲,平衡常数只与温度有关,温度改变,平衡常数也改变,故B正确;
C、增大压强,平衡常数不变,故C错误;
D、根据表中数据可知,在反应中X减小0.05mol/L,Y减小0.15mol/L,所以X、Y是反应物,Z增加了0.1mol/L,所以Z是生成物,X、Y、Z的浓度的变化量之比为1:3:2,所以化学方程式为X+3Y?2Z,平衡常数为
| 0.12 |
| 0.05×0.053 |
故选C.
点评:本题主要考查转化率的计算、影响平衡常数的因素、化学方程式的确定及平衡常数的计算等知识点,难度不大.注重对基础知识的考查.

练习册系列答案
相关题目
在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( )
| A、2A+3B=2C |
| B、A+3B=2C |
| C、3A+B=2C |
| D、A+B=C |
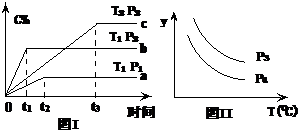 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
下列关于金属腐蚀的说法中不正确的是( )
| A、金属腐蚀的本质是金属原子失去电子而被氧化 |
| B、金属腐蚀一般包括化学腐蚀和电化学腐蚀 |
| C、纯的金属一般难以发生电化学腐蚀 |
| D、镀锌铁当镀层破损后,镀层则对铁失去了保护作用 |
如图装置分别通电一段时间后,溶液的质量增加的是( )
A、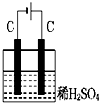 |
B、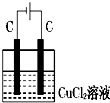 |
C、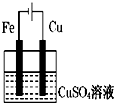 |
D、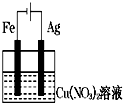 |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C、CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
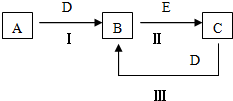 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.