题目内容
 设计总反应为:2Fe3++Fe═3Fe2+原电池,在框内画出图示.并写出两极反应式.
设计总反应为:2Fe3++Fe═3Fe2+原电池,在框内画出图示.并写出两极反应式.正极:
负极:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:2Fe3++Fe═3Fe2+中,Fe失电子被氧化,应该为负极,不如Fe活泼的金属或导电的非金属作正极,Fe3+得电子被还原,则含有铁离子的可溶性盐作电解质,据此分析解答.
解答:
解:2Fe3++Fe═3Fe2+中,Fe失电子被氧化,应该为负极,不如Fe活泼的金属或导电的非金属作正极,Fe3+得电子被还原,则含有铁离子的可溶性盐作电解质,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+、正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-═2Fe2+,则原电池装置图可设计为: ,故答案为:2Fe3++2e-═2Fe2+;Fe-2e-═Fe2+;
,故答案为:2Fe3++2e-═2Fe2+;Fe-2e-═Fe2+; .
.
 ,故答案为:2Fe3++2e-═2Fe2+;Fe-2e-═Fe2+;
,故答案为:2Fe3++2e-═2Fe2+;Fe-2e-═Fe2+; .
.
点评:本题考查了原电池设计,明确原电池原理是解本题关键,再根据方程式中元素化合价变化确定正负极材料及电解质溶液,同时考查学生分析问题、解决问题的能力,题目难度不大.

练习册系列答案
相关题目
向50mL 18mol/L的硫酸中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量( )
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol 和0.9mol之间 |
| D、等于0.9mol |
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)?3C(g)+D(g),达到平衡状态的是( )
| A、器内压强不随时间变化而变化 |
| B、反应器内A、B、C、D物质的量比为1:3:3:1 |
| C、生成A的速率和生成的D的速率相等 |
| D、生成 1mol A同时有3 mol C被消耗 |
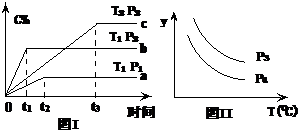 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
下列变化能够实现的是( )
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
| A、全部 | B、只有①③⑤ |
| C、只有②④⑥ | D、只有①②③④ |
如图装置分别通电一段时间后,溶液的质量增加的是( )
A、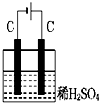 |
B、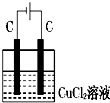 |
C、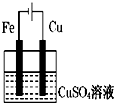 |
D、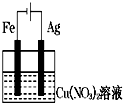 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
| A、电池工作时,锌是负极,发生氧化反应 |
| B、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| D、电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 |
构造原理揭示的电子排布能级顺序,实质是各能级能量高低.若以E(nl)表示某能级的能量,以下各式中正确的是( )
| A、E(4s)>E(3s)>E(2s)>E(1s) |
| B、E(3d)>E(4s)>E(3p)>E(3s) |
| C、E(5s)>E(4f)>E(4s)>E(3d) |
| D、E(5s)>E(4s)>E(4f)>E(3d) |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氩原子的氩气在标准状况下的体积约为11.2 L |
| B、17g 氨气含有的电子数为10NA |
| C、18g D2O中含有的氧原子数为NA |
| D、标准状况下,22.4LCCl4含有的分子数为NA |