题目内容
如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )


| A、500mL 2.0mol?L-1 HCl和500mL 2.0mol?L-1 NaOH的反应符合图1,且△E=57.3kJ |
| B、500mL 2.0mol?L-1 H2SO4和500mL 2.0mol?L-1 Ba(OH)2的反应符合图2,且△E=114.6kJ |
| C、CaO、浓硫酸溶于水时的能量变化符合图1 |
| D、发生图1能量变化的任何反应,一定不需加热即可发生 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:图1表示的反应物能量高于生成物是放热反应,图2表示的反应物能量低于生成物是吸热反应,据此分析.
解答:
解:图1表示的反应物能量高于生成物是放热反应,图2表示的反应物能量低于生成物是吸热反应,
A、HCl和NaOH反应放热,且生成1mol水,是中和热,符合图1,故A正确;
B、硫酸与氢氧化钡反应放热,且生成硫酸钡放出热量,△E≠114.6kJ,若A合理,则也不符合图1,故B错误;
C、浓硫酸溶于水虽然放热,但是物理变化,图1表示的是化学反应过程中的能量变化,故C错误;
D、焓变的大小与反应条件无关,故D错误;
故选A.
A、HCl和NaOH反应放热,且生成1mol水,是中和热,符合图1,故A正确;
B、硫酸与氢氧化钡反应放热,且生成硫酸钡放出热量,△E≠114.6kJ,若A合理,则也不符合图1,故B错误;
C、浓硫酸溶于水虽然放热,但是物理变化,图1表示的是化学反应过程中的能量变化,故C错误;
D、焓变的大小与反应条件无关,故D错误;
故选A.
点评:本题考查了放热反应和吸热反应的图示,并据此分析常见的放热反应和吸热反应,注意物理变化无所谓放热反应吸热反应.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
结构简式为CH3CH2OH的物质不能归属于( )
| A、有机物 | B、烃的衍生物 |
| C、醇类 | D、氧化物 |
向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是( )
| A、Cl- |
| B、OH- |
| C、AlO2- |
| D、HCO3- |
在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( )
| A、2A+3B=2C |
| B、A+3B=2C |
| C、3A+B=2C |
| D、A+B=C |
在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)?3C(g)+D(g),达到平衡状态的是( )
| A、器内压强不随时间变化而变化 |
| B、反应器内A、B、C、D物质的量比为1:3:3:1 |
| C、生成A的速率和生成的D的速率相等 |
| D、生成 1mol A同时有3 mol C被消耗 |
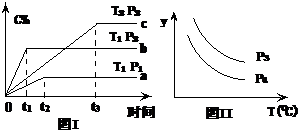 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
| A、P3<P4 y轴表示A的转化率 |
| B、P3>P4 y轴表示B的百分含量 |
| C、P3>P4 y轴表示混合气体的密度 |
| D、P3>P4y轴表示混合气体的平均相对分子质量 |
如图装置分别通电一段时间后,溶液的质量增加的是( )
A、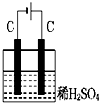 |
B、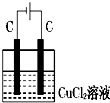 |
C、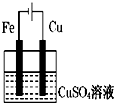 |
D、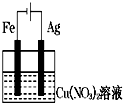 |
有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b,阴离子所带的负电荷数为c>d.则四种元素核电荷数由小到大的顺序为( )
| A、d<c<a<b |
| B、c<d<b<a |
| C、d<a<b<c |
| D、c<d<a<b |