题目内容
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图1,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
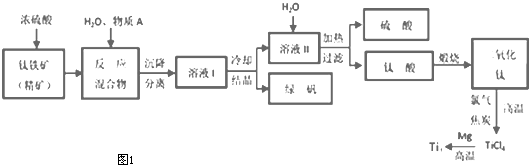
回答下列问题:
(1)钛铁矿和浓硫酸反应属于 (选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是 、 .
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是 .
(4)由二氧化钛制取四氯化钛所涉及的反应有:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1C(s)+CO2(g)=2CO(g)△△H3=+282.8kJ?mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是 .
②反应C(s)+O2(g)=CO2(g)的△H= .
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
(6)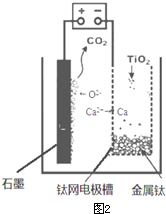
①写出阳极所发生反应的电极反应式: .
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) .

回答下列问题:
(1)钛铁矿和浓硫酸反应属于
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是
(4)由二氧化钛制取四氯化钛所涉及的反应有:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1C(s)+CO2(g)=2CO(g)△△H3=+282.8kJ?mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是
②反应C(s)+O2(g)=CO2(g)的△H=
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.
(6)

①写出阳极所发生反应的电极反应式:
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)
考点:金属冶炼的一般原理,用盖斯定律进行有关反应热的计算,电解原理
专题:化学反应中的能量变化
分析:(1)根据氧化还原反应中元素的化合价发生变化进行分析判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)①根据反应能否自发进行的判据△H-T△S来判断;
②根据盖斯定律来计算化学反应的焓变;
(6)①依据装置图分析判断,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变.
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)①根据反应能否自发进行的判据△H-T△S来判断;
②根据盖斯定律来计算化学反应的焓变;
(6)①依据装置图分析判断,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳;
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑,2Ca+TiO2
| ||
解答:
解:(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸,故答案为:Fe;绿矾;硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)①根据反应能否自发进行的判据△H-T△S,△H>0,所以高温下才自发进行,说明该反应的△S>0(或熵增加),故答案为:△S>0(或熵增加);
②已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ?mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ?mol-1-282.8kJ?mol-1-38.8kJ?mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变;
或:制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑;2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变;
故答案为:制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
Ti+2CaO,由此可见,CaO的量不变.
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸,故答案为:Fe;绿矾;硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)①根据反应能否自发进行的判据△H-T△S,△H>0,所以高温下才自发进行,说明该反应的△S>0(或熵增加),故答案为:△S>0(或熵增加);
②已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ?mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ?mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ?mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ?mol-1-282.8kJ?mol-1-38.8kJ?mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
故答案为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
| ||
或:制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e-═2Ca 阳极:2O2--4e-═O2↑;2Ca+TiO2
| ||
故答案为:制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2
| ||
点评:本题综合考查了元素化合物的性质知识,注意物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,电解池原理的应用,电极反应的书写原则等,要求学生具有分析和解决问题的能力,有利于培养学生的良好的科学素养,题目难度中等.

练习册系列答案
相关题目
关于如图实验的说法正确的是( )

| A、实验Ⅰ:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成.该现象是由于甲烷与氯气在光照条件下发生了置换反应 |
| B、实验Ⅱ:可以比较KMnO4、Cl2和S氧化性的相对强弱 |
| C、实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定可产生丁达尔效应 |
下列判断合理的是( )
| A、检验溶液中是否有SO42-可依次加入的试剂是BaCl2溶液和稀盐酸 |
| B、在pH=2的溶液中可能大量含有:Na+、AlO2-、CO32-、SO32- |
| C、在常温下加入铝粉有氢气放出,则溶液中可能大量含有:K+、Na+、OH-、NO3- |
| D、使紫色石蕊试液变蓝色的溶液中可能大量含有:K+、Na+、Ca2+、HCO3- |
在一定条件下,将CO和O2的混合气体37g充入一体积固定不变的密闭容器(容器内有足量的Na2O2固体),此时容器的压强为p1,用电火花不间断的点燃,使其充分反应,恢复至原温度,结果固体增重21g,此时容器的压强为p2,则
为( )
| p1 |
| p2 |
| A、2:5 | B、5:2 |
| C、7:6 | D、6:7 |
工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠晶体(Na2Cr2O7?2H2O),其主要反应为:(1)4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O下列说法正确的是( )
| 高温 |
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,氧化产物是Na2CrO4和Fe2O3 |
| C、高温下O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成2molFe2O3时电子转移4mol |
某溶液中含有大量的下列离子:Fe3+、SO42-、A13+和M离子,经测定Fe3+、SO42-、A13+和M离子的物质的量之比为2:3:1:3,则M离子可能是下列中的( )
| A、Na+ |
| B、OH- |
| C、S2- |
| D、C1- |
《科学》杂志评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一.下列关于水的说法中正确的是( )
| A、水在常温下属于分子晶体 |
| B、水的电离和电解都需要通电 |
| C、水分子很稳定是因为H-O共价键键能大 |
| D、金属的电化学腐蚀与水无关 |