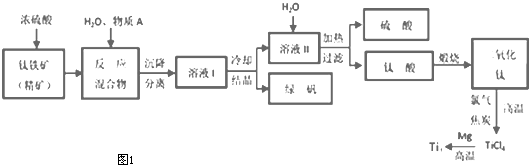
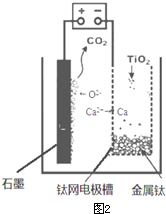
题目内容
工业上以铬铁矿(主要成分为FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠晶体(Na2Cr2O7?2H2O),其主要反应为:(1)4FeO?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O下列说法正确的是( )
| 高温 |
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,氧化产物是Na2CrO4和Fe2O3 |
| C、高温下O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成2molFe2O3时电子转移4mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:A.反应(2)中不存在元素的化合价变化;
B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.氧化剂的氧化性大于氧化产物的氧化性;
D.反应(1)中每生成2molFe2O3时,7mol氧化剂参加反应.
B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.氧化剂的氧化性大于氧化产物的氧化性;
D.反应(1)中每生成2molFe2O3时,7mol氧化剂参加反应.
解答:
解:A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;
B.反应(1)中O元素的化合价降低,所以氧化剂是O2,Fe、Cr元素的化合价均升高,还原剂是FeO?Cr2O3,氧化产物是Na2CrO4和Fe2O3,故B正确;
C.氧化剂的氧化性大于氧化产物的氧化性,则高温下O2的氧化性强于Fe2O3,强于Na2CrO4,故C错误;
D.反应(1)中每生成2molFe2O3时,7mol氧化剂参加反应,则转移电子为7mol×2×[0-(-2)]=28mol,故D错误;
故选B.
B.反应(1)中O元素的化合价降低,所以氧化剂是O2,Fe、Cr元素的化合价均升高,还原剂是FeO?Cr2O3,氧化产物是Na2CrO4和Fe2O3,故B正确;
C.氧化剂的氧化性大于氧化产物的氧化性,则高温下O2的氧化性强于Fe2O3,强于Na2CrO4,故C错误;
D.反应(1)中每生成2molFe2O3时,7mol氧化剂参加反应,则转移电子为7mol×2×[0-(-2)]=28mol,故D错误;
故选B.
点评:本题考查氧化还原反应,为高频考点,注意判断反应中元素的化合价变化即可解答,选项C为解答的易错点,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
要使含有Ag+、Cu2+、Mg2+、Ba2+等离子的溶液中的离子逐一形成沉淀析出,下列所选择试剂及加入试剂的顺序正确的是( )
| A、H2SO4→HCl→K2S→NaOH→CO2 |
| B、Na2SO4→NaCl→Na2S→NH3?H2O |
| C、NaCl→Na2SO4→H2S→NaOH |
| D、Na2S→Na2SO4→NaCl→NaOH |
在某无色透明的酸性溶液中,能共存的离子组是( )
| A、NH4+、NO3-、Al3+、Cl- |
| B、Na+、AlO2-、K+、NO3- |
| C、MnO4-、K+、SO42-、Na+ |
| D、K+、SO42-、HCO3-、Na+ |
将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( )
| A、稀盐酸 |
| B、K2SO4 |
| C、CuCl2 |
| D、NaOH溶液 |
下列说法正确的是( )
| A、含硅材料广泛用于太阳能电板、半导体材料、光纤通讯以及建筑材料等 |
| B、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| C、工艺师利用稀盐酸刻蚀石英制作艺术品 |
| D、粗硅制备单晶硅不涉及氧化还原反应 |
下列化合物中,氯元素的化合价为+5价的是( )
| A、HCl |
| B、NaCl |
| C、KClO3 |
| D、KClO4 |
设NA为阿伏伽德罗常数,下列说法正确的是( )
| A、电解精炼铜过程中,电路中每通过NA个电子,阳极溶解铜32g |
| B、1L 2mol/L的NH4CI溶液中含NH4+数目为2NA |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| D、1molC20H42的分子中含有的共价键数目为61NA |
二维平面晶体所表示的化学式为AX2的是( )
A、 |
B、 |
C、 |
D、 |