题目内容
氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:NO
+4H++3e-=NO+2H2O.下列四种物质:KMnO4,Na2CO3,KI,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生.
(1)发生氧化反应的物质是 ;
(2)写出并配平该氧化还原反应方程式 ;
(3)反应生成0.3mol H2O,则转移电子的数目为 ;
(4)若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂的物质的量之比将 (填“增大”、“减小”、“不变”或“不能确定”).
- 3 |
(1)发生氧化反应的物质是
(2)写出并配平该氧化还原反应方程式
(3)反应生成0.3mol H2O,则转移电子的数目为
(4)若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂的物质的量之比将
考点:氧化还原反应
专题:氧化还原反应专题
分析:由还原过程发生氧化反应可知,N元素的化合价升高,则与还原剂发生氧化还原反应,在题给四种物质中,能发生氧化反应的只有KI,被还原的元素为N,还原剂是KI,发生反应的化学方程式为6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O,结合化合价的变化计算.
解答:
解:(1)题给四种物质中,能发生氧化反应的只有KI,被还原的元素为N,还原剂是KI,故答案为:KI;
(2)反应的方程式应为6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O,故答案为:6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O;
(3)反应6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O中转移的电子数为6e-,即每生成4 molH2O,转移6mol电子.因此若生成0.3 molH2O,转移0.45NA电子,
故答案为:0.45NA;
(4)若反应后氧化产物的化合价升高,则需氧化剂的物质的量增大,故氧化剂与还原剂的物质的量之比增大,故答案为:增大.
(2)反应的方程式应为6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O,故答案为:6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O;
(3)反应6KI+8HNO3═6KNO3+2NO↑+3I2+4H2O中转移的电子数为6e-,即每生成4 molH2O,转移6mol电子.因此若生成0.3 molH2O,转移0.45NA电子,
故答案为:0.45NA;
(4)若反应后氧化产物的化合价升高,则需氧化剂的物质的量增大,故氧化剂与还原剂的物质的量之比增大,故答案为:增大.
点评:本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考常见题型,本题可根据配平后的化学方程式计算,难度中等.

练习册系列答案
相关题目
下列小实验设计肯定合理的是( )
| A、用AgNO3鉴别工业盐(亚硝酸钠)和食盐二种溶液 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
某离子化合物的晶胞如图所示立体结构,晶胞是整个晶体中最基本的重复单位.小黑球表示阳离子,小白球表示阴离子,该离子化合物中,阴、阳离子个数比是( )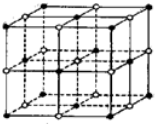

| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
把0.05molNaOH固体分别加入到100mL液体中,溶液的导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1氨水溶液 |
某元素在化学反应中由化合态变为游离态,则该元素( )
| A、一定被氧化了 |
| B、一定被还原了 |
| C、既可能被氧化也可能被还原 |
| D、既不可能被氧化,也不可能被还原 |
相同状态下,10体积A2气体和20体积B2气体化合成20体积气体C,则C的化学式为( )
| A、AB |
| B、A2B |
| C、AB3 |
| D、AB2 |
下列各组离子一定能大量共存的是( )
| A、在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ |
| B、在c(H+)=0.1mol?L-1的溶液中:K+、I-、Cl-、NO3- |
| C、在pH=12的溶液中:NH4+、Na+、SO42-、Cl- |
| D、在强碱溶液中:Na+、K+、CO32-、NO3- |