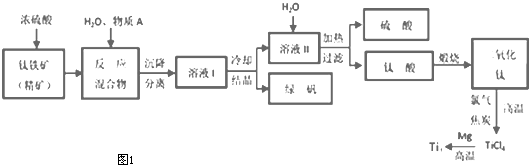
题目内容
下列判断合理的是( )
| A、检验溶液中是否有SO42-可依次加入的试剂是BaCl2溶液和稀盐酸 |
| B、在pH=2的溶液中可能大量含有:Na+、AlO2-、CO32-、SO32- |
| C、在常温下加入铝粉有氢气放出,则溶液中可能大量含有:K+、Na+、OH-、NO3- |
| D、使紫色石蕊试液变蓝色的溶液中可能大量含有:K+、Na+、Ca2+、HCO3- |
考点:离子共存问题,离子反应发生的条件
专题:离子反应专题
分析:A.应先加盐酸排除其它离子的干扰;
B.pH=2的溶液,显酸性;
C.加入铝粉有氢气放出,溶液为非氧化性酸或强碱溶液;
D.使紫色石蕊试液变蓝色的溶液,显碱性.
B.pH=2的溶液,显酸性;
C.加入铝粉有氢气放出,溶液为非氧化性酸或强碱溶液;
D.使紫色石蕊试液变蓝色的溶液,显碱性.
解答:
解:A.应先加盐酸排除其它离子的干扰,则验溶液中是否有SO42-可依次加入的试剂是稀盐酸、BaCl2溶液,故A错误;
B.pH=2的溶液,显酸性,不能大量存在AlO2-、CO32-、SO32-,故B错误;
C.加入铝粉有氢气放出,溶液为非氧化性酸或强碱溶液,碱性溶液中该组离子之间不反应,可大量共存,故C正确;
D.使紫色石蕊试液变蓝色的溶液,显碱性,OH-、Ca2+、HCO3-结合生成沉淀和水,不能大量共存,故D错误;
故选C.
B.pH=2的溶液,显酸性,不能大量存在AlO2-、CO32-、SO32-,故B错误;
C.加入铝粉有氢气放出,溶液为非氧化性酸或强碱溶液,碱性溶液中该组离子之间不反应,可大量共存,故C正确;
D.使紫色石蕊试液变蓝色的溶液,显碱性,OH-、Ca2+、HCO3-结合生成沉淀和水,不能大量共存,故D错误;
故选C.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应及离子检验的考查,题目难度不大.

练习册系列答案
相关题目
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、在一定条件下可以发生加成反应 |
| C、在碱性条件下不水解 |
| D、属于卤代烃 |
下列有关电解的说法正确的是( )
| A、用惰性电极电解饱和食盐水初期,只需在溶液中加入适量的盐酸即可恢复至原溶液 | ||||
| B、工业上用电解熔融的氯化镁冶炼镁,也可采用电解熔融的氯化铝冶炼铝 | ||||
| C、工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子 | ||||
D、用惰性电极电解CuSO4溶液,有可能发生Cu2++2H2O
|
某离子化合物的晶胞如图所示立体结构,晶胞是整个晶体中最基本的重复单位.小黑球表示阳离子,小白球表示阴离子,该离子化合物中,阴、阳离子个数比是( )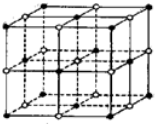

| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
在某无色透明的酸性溶液中,能共存的离子组是( )
| A、NH4+、NO3-、Al3+、Cl- |
| B、Na+、AlO2-、K+、NO3- |
| C、MnO4-、K+、SO42-、Na+ |
| D、K+、SO42-、HCO3-、Na+ |
把0.05molNaOH固体分别加入到100mL液体中,溶液的导电能力变化不大的是( )
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1氨水溶液 |
已知NA为阿伏伽德罗常数,下列说法不正确的是( )
| A、醋酸的摩尔质量与NA个醋酸分子的质量当以克为单位时在数值上相等 |
| B、22g二氧化碳与11.2L的HCl含有相同的分子数 |
| C、常温常压下,17gNH3所含有的原子数为4NA |
| D、500mL 0.2mol?L-1的Ba(NO3)2溶液中NO3-的物质的量浓度为0.4mol?L-1 |
 实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:
实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器: