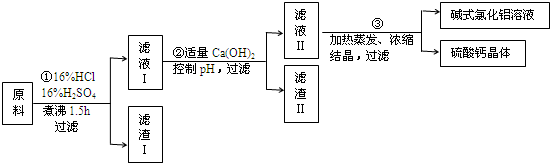
题目内容
 “白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.已知:
锌与强碱溶液反应的离子方程式为:Zn+20H-=Zn022-+H2↑锌的密度为
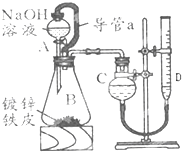
dg/cm3,某学习小组同学设计了如图装置,使单侧面积为Scm2、质量为mg,的镀锌铁皮完全浸人6mol?L-1NaOH溶液中,充分反应.回答下列问题:
(1)仪器名称A
(2)装置中导管 a 的作用是
(3)干燥管C与量气管D(具有刻度的细长玻璃管)在反应前后液面高度有何要求:反应前
其目的是
(4)除了锌之外,另一种常见金属与强碱溶液反应的离子方程式为
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液
(6)实验前后量气管中液面读数分别为 V1mL、V2mL,(实验条件的气体摩尔体积为Vm L?mol-1),则镀锌铁皮的厚度为h=
(7)请另设计一种测镀锌膜的厚度的方案,并用简单的方式表述出来:
考点:探究物质的组成或测量物质的含量,常见金属元素的单质及其化合物的综合应用
专题:实验探究和数据处理题
分析:(1)依据装置图仪器和作用分析仪器名称;
(2)装置中导管a的作用是保持压强相同是氢氧化钠顺利从分液漏斗滴下;
(3)本实验的关键是测量气体的体积,所以是开始先把量气管两端液面相平后,读数记录,加入氢氧化钠溶液到不再有气体放出,恢复室温再把量气管连段液面相平读数;
(4)除了锌之外,另一种常见金属与强碱溶液反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液,取B中反应后的溶液中加入足量硝酸溶解后家里有铁离子检验试剂和反应现象检验;
(6)依据锌镀层厚度=
,锌的体积=
,锌的质量=n(Zn)×M(Zn),反应的锌和生成的氢气物质的量相同;
(7)镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算;
(2)装置中导管a的作用是保持压强相同是氢氧化钠顺利从分液漏斗滴下;
(3)本实验的关键是测量气体的体积,所以是开始先把量气管两端液面相平后,读数记录,加入氢氧化钠溶液到不再有气体放出,恢复室温再把量气管连段液面相平读数;
(4)除了锌之外,另一种常见金属与强碱溶液反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液,取B中反应后的溶液中加入足量硝酸溶解后家里有铁离子检验试剂和反应现象检验;
(6)依据锌镀层厚度=
| V |
| S |
| m |
| ρ |
(7)镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算;
解答:
解:(1)装置图分析可知仪器A为分液漏斗,装置B为锥形瓶;
故答案为:分液漏斗,锥形瓶;
(2)装置中导管a的作用是使分液漏斗和锥形瓶内气压相同,氢氧化钠溶液能顺利滴下;
故答案为:将AB连通,平衡两者气压,使液体能顺利流下;
(3)根据此装置的原理,应两次记录D中的读数,取其差值就是所得气体的体积,所以第一步就应该是检查气密性,将药品和水装入各仪器中,连接好装置后,然后是记录D的液面位置;再就是由A向B中滴加足量NaOH溶液;待B中不再有气体产生并恢复至室温,把量气管上下移动D,使干燥管和D中液面相平读数来计算,反应前C中液面与D中液面相平,反应后C中液面与D中液面相平,目的保证BC装置内的气压始终恒定;.
故答案为:C中液面与D中液面相平,C中液面与D中液面相平,保证BC装置内的气压始终恒定;
(4)除了锌之外,另一种常见金属与强碱溶液反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液,取B中反应后的溶液中加入足量硝酸溶溶液利用铁离子检验试剂和反应现象检验,取B反应后的剩余液,加入足量的稀硝酸酸化,再滴入KSCN溶液,未见变红说明铁未与氢氧化钠溶液反应;
故答案为:取B反应后的剩余液,加入足量的稀硝酸酸化,再滴入KSCN溶液,未见变红说明:
(6)V(H2)=(V2-V1) mL,n(Zn)=n(H2)=
,m(Zn)=65 g?mol-1 n(Zn);,锌的密度是d g?cm-3,V(Zn)=
=
;由于铁片表面有上、下两层,所以每一层的厚度h=
=
=
;
故答案为:
;
(7)镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算;
故答案为:镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算;
故答案为:分液漏斗,锥形瓶;
(2)装置中导管a的作用是使分液漏斗和锥形瓶内气压相同,氢氧化钠溶液能顺利滴下;
故答案为:将AB连通,平衡两者气压,使液体能顺利流下;
(3)根据此装置的原理,应两次记录D中的读数,取其差值就是所得气体的体积,所以第一步就应该是检查气密性,将药品和水装入各仪器中,连接好装置后,然后是记录D的液面位置;再就是由A向B中滴加足量NaOH溶液;待B中不再有气体产生并恢复至室温,把量气管上下移动D,使干燥管和D中液面相平读数来计算,反应前C中液面与D中液面相平,反应后C中液面与D中液面相平,目的保证BC装置内的气压始终恒定;.
故答案为:C中液面与D中液面相平,C中液面与D中液面相平,保证BC装置内的气压始终恒定;
(4)除了锌之外,另一种常见金属与强碱溶液反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)请设计实验证明,铁并未与强碱溶液反应而进入溶液,取B中反应后的溶液中加入足量硝酸溶溶液利用铁离子检验试剂和反应现象检验,取B反应后的剩余液,加入足量的稀硝酸酸化,再滴入KSCN溶液,未见变红说明铁未与氢氧化钠溶液反应;
故答案为:取B反应后的剩余液,加入足量的稀硝酸酸化,再滴入KSCN溶液,未见变红说明:
(6)V(H2)=(V2-V1) mL,n(Zn)=n(H2)=
| V2-V1 |
| 1000Vm |
| m |
| ρ |
| m(Zn) |
| d |
| V(Zn) |
| 2S |
| ||
| 2S×d |
| 13(V2-V1) |
| 400VmdS |
故答案为:
| 13(V2-V1) |
| 400VmdS |
(7)镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算;
故答案为:镀锌铁皮与强碱反应后,测剩余铁的质量,获得锌的质量,再进行换算;
点评:本题考查了物质性质的实验设计和步骤分析判断,装置分析是解题关键,注意金属厚度的计算方法应用,题目难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目