题目内容
将40.4g过氧化钠与氧化钠的固体混合物溶入水充分反应,得到体积为1000mL1.2mol/L的NaOH溶液,
计算(1)原固体混合物中Na2O的质量为 .
(2)若恰好中和上述反应后所得溶液需要加入2.0mol/L的HCl体积 .
计算(1)原固体混合物中Na2O的质量为
(2)若恰好中和上述反应后所得溶液需要加入2.0mol/L的HCl体积
考点:有关混合物反应的计算
专题:
分析:(1)设出氧化钠、过氧化钠的物质的量,然后根据混合物总质量、钠离子守恒列式计算出氧化钠的物质的量,再根据m=nM计算出氧化钠的质量;
(2)根据酸碱中和反应的实质计算出需要氯化氢的物质的量,再根据V=
计算出需要改盐酸的体积.
(2)根据酸碱中和反应的实质计算出需要氯化氢的物质的量,再根据V=
| n |
| c |
解答:
解:(1)设氧化钠、过氧化钠的物质的量分别为x、y,
根据混合物质量可得:①62x+78y=40.4,
根据钠离子守恒可得:②2x+2y=1.2mol/L×1L=1.2mol,
联立①②解得:x=0.4mol、y=0.2mol,
混合物中氧化钠的质量为:62g/mol×0.4mol=24.8g,
故答案为:24.8g;
(2)反应后的溶液中氢氧化钠的物质的量为:1.2mol/L×1L=1.2mol,
根据中和反应实质可得:n(HCl)=n(NaOH)=1.2mol,
需要加入2.0mol/L的HCl体积为:
=0.6L=600mL,
故答案为:600mL.
根据混合物质量可得:①62x+78y=40.4,
根据钠离子守恒可得:②2x+2y=1.2mol/L×1L=1.2mol,
联立①②解得:x=0.4mol、y=0.2mol,
混合物中氧化钠的质量为:62g/mol×0.4mol=24.8g,
故答案为:24.8g;
(2)反应后的溶液中氢氧化钠的物质的量为:1.2mol/L×1L=1.2mol,
根据中和反应实质可得:n(HCl)=n(NaOH)=1.2mol,
需要加入2.0mol/L的HCl体积为:
| 1.2mol |
| 2mol/L |
故答案为:600mL.
点评:本题考查了有关混合物的计算,题目难度中等,注意掌握钠及其化合物性质及物质的量与物质的量浓度、摩尔质量之间关系,明确反应原理为解答关键,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、用固体NaOH配制一定物质的量浓度的NaOH溶液时,NaOH溶于水后,应冷却至室温才能转移到容量瓶中 |
下列各组混合物,可以用分液漏斗分离的是( )
| A、苯和乙醇 | B、乙酸和水 |
| C、溴苯和苯 | D、三氯甲烷和水 |
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是( )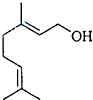

| A、香叶醇的分子式为C10H20O |
| B、不能使溴的四氯化碳溶液褪色 |
| C、不能发生催化氧化反应生成醛 |
| D、既能发生加成反应又能发生取代反应 |
32g某一元醇跟足量的金属钠完全反应,可以得到11.2L(标准状况)氢气,该醇是( )
| A、CH3OH |
| B、C2H5OH |
| C、C3H7OH |
| D、C4H9OH |

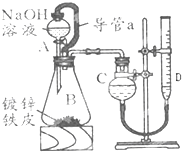 “白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.

