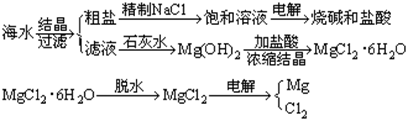
题目内容
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
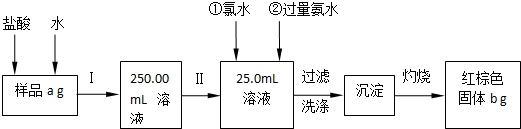
请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 .(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是 (填写序号).
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子方程式 ,
(4)若原样品质量a为50g,加热后红棕色固体质量b为3g,则样品中铁元素的质量分数是 .

请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)下列操作可能使所配溶液浓度偏小的是
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子方程式
(4)若原样品质量a为50g,加热后红棕色固体质量b为3g,则样品中铁元素的质量分数是
考点:探究物质的组成或测量物质的含量,氯气的化学性质,配制一定物质的量浓度的溶液
专题:实验探究和数据处理题
分析:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要100mL的容量瓶,定容需要胶头滴管;
(2)依据溶液配制过程和实验步骤分析判断选项中,各操作对浓度的影响分析判断
(3)加氯水就是让+2价铁变为+3价;
(4)加热分解所得的物质是Fe2O3,其质量为3g,由于用去25mL溶液,故250mL溶液可以得到Fe2O3质量为30g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数;
(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要100mL的容量瓶,定容需要胶头滴管;
(2)依据溶液配制过程和实验步骤分析判断选项中,各操作对浓度的影响分析判断
(3)加氯水就是让+2价铁变为+3价;
(4)加热分解所得的物质是Fe2O3,其质量为3g,由于用去25mL溶液,故250mL溶液可以得到Fe2O3质量为30g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数;
解答:
解:(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,所用到的玻璃仪器除烧杯、玻璃棒外,需要250mL容量瓶,还需要用胶头滴管定容,
故答案为:250mL容量瓶、胶头滴管;
(2)依据溶液配制过程和实验步骤分析判断选项,操作可能使所配溶液浓度偏小:
①未洗涤烧杯和玻璃棒,溶质未全部转移到容量瓶,浓度偏低,故①符合;
②定容时俯视容量瓶的刻度线,容量瓶中水未加到刻度线,浓度偏大,故②不符合;
③配溶液前容量瓶中有少量蒸馏水对配置溶液浓度无影响,故③不符合;
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切,溶液浓度稀释偏小,故④符合;
故答案为:①④;
(3)加氯水就是让+2价铁变为+3价,发生反应为:2Fe 2++Cl2=2Fe 3++2Cl-,
故答案为:2Fe 2++Cl2=2Fe 3++2Cl-;
(4)加热分解所得的物质是Fe2O3,其质量为3g,由于用去25mL溶液,故250mL溶液可以得到Fe2O3质量为30g,依据铁元素守恒计算铁元素的质量分数=
×100%=42%:
故答案为:42%;
故答案为:250mL容量瓶、胶头滴管;
(2)依据溶液配制过程和实验步骤分析判断选项,操作可能使所配溶液浓度偏小:
①未洗涤烧杯和玻璃棒,溶质未全部转移到容量瓶,浓度偏低,故①符合;
②定容时俯视容量瓶的刻度线,容量瓶中水未加到刻度线,浓度偏大,故②不符合;
③配溶液前容量瓶中有少量蒸馏水对配置溶液浓度无影响,故③不符合;
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切,溶液浓度稀释偏小,故④符合;
故答案为:①④;
(3)加氯水就是让+2价铁变为+3价,发生反应为:2Fe 2++Cl2=2Fe 3++2Cl-,
故答案为:2Fe 2++Cl2=2Fe 3++2Cl-;
(4)加热分解所得的物质是Fe2O3,其质量为3g,由于用去25mL溶液,故250mL溶液可以得到Fe2O3质量为30g,依据铁元素守恒计算铁元素的质量分数=
| ||
| 50g |
故答案为:42%;
点评:本题考查溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
下列反应中符合下列图象的是( )
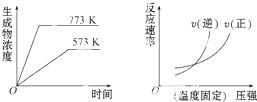

| A、N2(g)+3H2(g)?2NH5(g)△H=-Q1kJ?mol-1(Q1>0) |
| B、2SO5(g)?2SO2(g)+O2(g)△H=+Q2kJ?mol-1(Q2>0) |
| C、4NH5(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q3kJ?mol-1(Q3>0) |
| D、H2(g)+CO(g)?C(g)+H2O(g)△H=+Q4kJ?mol-1(Q4>0) |
下列化学实验操作或事故处理犯法不正确的是( )
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将碱液沾带皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
| C、酒精灯着火时,用湿抹布盖灭 |
| D、稀释浓硫酸时,可向盛浓硫酸的烧杯中小心注入蒸馏水,边加边搅拌 |
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是( )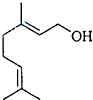

| A、香叶醇的分子式为C10H20O |
| B、不能使溴的四氯化碳溶液褪色 |
| C、不能发生催化氧化反应生成醛 |
| D、既能发生加成反应又能发生取代反应 |
已知25℃时合成氨反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol.一定压强下,向10L的密闭容器里充入1mol N2和3mol H2,达到平衡后,NH3的体积分数为60%.若相同条件下,向同一密闭容器里改充入2mol NH3,产生的热效应为a,此时NH3的转化率为α.则下列判断正确的是( )
| A、a=-23.1kJα=40% |
| B、a=-23.1kJ α=25% |
| C、a=+23.1kJα=40% |
| D、a=+23.1kJ α=25% |
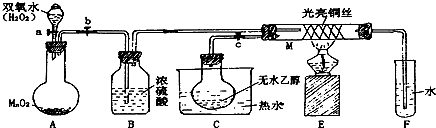
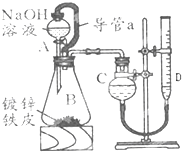 “白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.
“白铁皮”即镀锌铁皮,镀锌层犹如铁皮的保护层,具有较强的耐腐蚀性,这层膜的厚度是判断白铁皮质量的重要指标,某研究性学习小组为了测定镀膜厚度,设计了下面的实验方案.