题目内容
3.铵明矾是一种广泛应用于医药、食品、污水处理等多个行业的重要化工产品.以高岭土(含SiO2、Al2O3、少量Fe2O3等)为原料制备硫酸铝晶体[Al2(SO4)3•18H2O]和铵明矾[NH4Al(SO4)2•12H2O]的工艺流程如下图所示.
请回答下列问题:
(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有bdef(填字母).
a.蒸发皿 b.泥三角 c.漏斗 d.酒精灯 e.三脚架 f.坩埚 g.烧杯 h.试管
(2)研究发现,随着酸熔温度升高,氧化铝的溶出率增大,但若酸熔时温度过高(超过240℃),SiO2不仅会消耗硫酸,导致氧化铝溶出率下降,还会同时产生高温的腐蚀性气体,该副反应的化学方程式为SiO2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑.
(3)要检验除铁后的滤液中是否含有Fe3+,应采取的实验方法为取少量除铁后的滤液于试管中,滴加几滴KSCN溶液,若溶液变为血红色则含Fe3+,否则不含Fe3+;滤渣2的主要成分为Fe(OH)3(填化学式).
(4)“分离1”操作包含的实验步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,写出该过程中的总反应方程式Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓
或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓.
分析 高岭土用浓硫酸溶解,Al2O3、Fe2O3反应得到Al2(SO4)3、Fe2(SO4)3,SiO2不与硫酸反应,过滤得到滤渣1为SiO2,滤液中含有Al2(SO4)3、Fe2(SO4)3及剩余的硫酸,
研究发现,随着酸熔温度升高,氧化铝的溶出率增大,但若酸熔时温度过高(超过240℃),SiO2不仅会消耗硫酸,导致氧化铝溶出率下降,还会同时产生高温的腐蚀性气体为三氧化硫,该副反应的化学方程式为SiO2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑;
向滤液中加入物质除去Fe元素,然后过滤,则滤渣2为氢氧化铁,将滤液蒸发浓缩、冷却结晶和过滤得到硫酸铝晶体,用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,反应方程式为Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓
或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,结合题目分析解答.
解答 解:高岭土用浓硫酸溶解,Al2O3、Fe2O3反应得到Al2(SO4)3、Fe2(SO4)3,SiO2不与硫酸反应,过滤得到滤渣1为SiO2,滤液中含有Al2(SO4)3、Fe2(SO4)3及剩余的硫酸,
研究发现,随着酸熔温度升高,氧化铝的溶出率增大,但若酸熔时温度过高(超过240℃),SiO2不仅会消耗硫酸,导致氧化铝溶出率下降,还会同时产生高温的腐蚀性气体为三氧化硫,该副反应的化学方程式为SiO2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑;
向滤液中加入物质除去Fe元素,然后过滤,则滤渣2为氢氧化铁,将滤液蒸发浓缩、冷却结晶和过滤得到硫酸铝晶体,用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,反应方程式为Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓
或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,
(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有盛放药品的仪器坩埚、泥三角、用于加热的仪器酒精灯、盛放泥三角的仪器三脚架,
故选bdef;
(2)通过以上分析知,二氧化硅和浓硫酸反应方程式为SiO2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑,
故答案为:SiO2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$H2SiO3+SO3↑;
(3)铁离子能和KSCN溶液反应生成血红色溶液,所以要检验除铁后的滤液中是否含有Fe3+,应采取的实验方法为取少量除铁后的滤液于试管中,滴加几滴KSCN溶液,若溶液变为血红色则含Fe3+,否则不含Fe3+;滤渣2的主要成分为Fe(OH)3,
故答案为:取少量除铁后的滤液于试管中,滴加几滴KSCN溶液,若溶液变为血红色则含Fe3+,否则不含Fe3+;Fe(OH)3;
(4)“分离1”操作包含的实验步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;过滤;
(5)通过以上分析知,该过程中的总反应方程式Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓,
故答案为:Al2(SO4)3+H2SO4+2NH3•H2O+22H2O=2[NH4Al(SO4)2•12H2O]↓或Al2(SO4)3+H2SO4+2NH3+24H2O=2[NH4Al(SO4)2•12H2O]↓.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析能力、实验基本操作能力等,明确流程图中发生的反应及基本操作方法、物质性质是解本题关键,知道常见仪器用途,题目难度不大.

 中考解读考点精练系列答案
中考解读考点精练系列答案| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
(2)最难形成简单离子的元素是He.
(3)单质具有半导体性质的元素是Si.
(4)元素的气态氢化物既不和所有的酸作用,又不和所有的碱作用的是C.
(5)能跟氙、氪形成二元化合物的元素是F.
(6)最新发现的一种单质是由60个原子组成球状结构的分子.这种单质叫足球烯,它是由C元素组成的.
(7)其单质能和冷水剧烈反应的元素是Na、F.
(8)a元素能以正化合价与b元素形成AB型化合物,该化合物常温下为固态且难溶于水,则a元素是Mg,b元素是O.
| A. | 0.80g | B. | 0.02g | C. | 0.23g | D. | 0.46g |
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 非电解质:乙醇、四氯化碳、氯气、葡萄糖 | |
| C. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
 .
.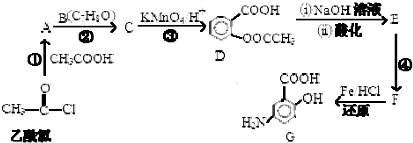
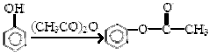 ,
, (具有还原性,极易被氧化)
(具有还原性,极易被氧化) .
. .
. (写出其中一种结构简式)
(写出其中一种结构简式)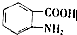 的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
的流程图(无机试剂任选).合成路线流程图如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题: