题目内容
5. 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
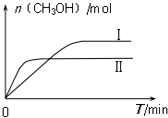
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
分析 (1)依据热化学方程式 和盖斯定律计算①-②×3得到,分析判断;
(2)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H;根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,据此判断平衡常数的变化;
②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围;
③达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答;
(3)二甲醚与空气可设计成燃料电池,若电解质为碱性,二甲醚在原电池负极失电子发生氧化反应生成碳酸盐,结合电荷守恒和原子守恒书写电极反应,2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).反应前后气体体积减小,增加压强平衡正向进行;
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0,根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ,
故答案为:<;>;
②设二氧化碳反应量为x
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始量(mol):1 3 0 0
转化量(mol):x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)/4=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
a.反应前后气体物质的量变化,当容器中压强不变,说明反应达到平衡状态,故a正确;
b.H2的体积分数不变是平衡标志,故b正确;
c.速率之比等于化学方程式计量数之比为正反应速率之比,c(H2)=3c(CH3OH),不能说明正逆反应速率相同,不能证明反应达到平衡状态,故c错误;
d.反应前后气体质量不变,体积不变,容器中密度始终不变,不能说明反应达到平衡状态,故d错误;
e.2个C=O断裂的同时有3个C-H形成只能说明反应正向进行,不能说明反应达到平衡状态,故d错误;
故答案为:a b;
(3)二甲醚与空气可设计成燃料电池,若电解质为碱性,二甲醚在原电池负极失电子发生氧化反应生成碳酸盐,结合电荷守恒和原子守恒书写电极反应为:CH3OCH3-12 e-+16OH-═2CO32-+11 H2O,反应(g)+4H2(g)?CH3OCH3(g)+H2O(g).反应前后气体体积减小,增加压强平衡正向进行,该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
故答案为:CH3OCH3-12 e-+16OH-═2CO32-+11 H2O;该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
点评 本题主要考查了热化学方程式的书写、电极反应的书写、化学平衡的判断和计算及氧化还原反应方程式的书写,综合性较强,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 3:2:1 | B. | 6:1:2 | C. | 7:1:3 | D. | 7:4:1 |
| A. | 硅的化学性质稳定,常温下不与任何物质反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅元素在地壳中的含量居第一位 | |
| C. | 硅在自然界中可以以游离态存在 | |
| D. | 高纯度的单质硅被广泛用于制作计算机芯片 |
| A. | C2H4 | B. | CH4 | C. | CH3COOCH2CH3 | D. | C2H5OH |
| A. | 1,2,4-三甲苯 | B. | 2,4,4-三甲基戊烷 | ||
| C. | 2-丁醇 | D. | 2-甲基丁烯 |
| A. | 氧化钙、消石灰、CaO | B. | 氢氧化钠、烧碱、NaOH | ||
| C. | 碳酸钙、熟石灰、CaCO3 | D. | 碳酸钠、小苏打、Na2CO3 |




