题目内容
17.下列有机物的命名错误的是( )| A. | 1,2,4-三甲苯 | B. | 2,4,4-三甲基戊烷 | ||
| C. | 2-丁醇 | D. | 2-甲基丁烯 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.1,2,4-三甲苯,在苯环的1、2、4号C各含有1个甲基,其结构简式为 ,故A正确;
,故A正确;
B.支链编号之和必须最小,正确命名为:2,2,4-三甲基戊烷,故B错误;
C.2-丁醇分子中,羟基在2号C,其结构简式为:CH3CH(OH)CH2CH3,故C正确;
D.2-甲基-2-丁烯,甲基和碳碳双键在2号C,该命名合理,故D正确;
故选B.
点评 本题考查了有机物的命名,题目难度中等,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
13.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及方法的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | b | A |
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
8.下列高分子化合物的认识不正确的是( )
| A. | 有机高分子化合物被称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而得到的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构很复杂 | |
| C. | 对于一块高分子材料来说,n是一个整数值,因而它的相对分子质量是确定的. | |
| D. | 材料可分为天然高分子材料和合成高分子材料两大类 |
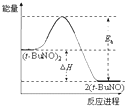
5. 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
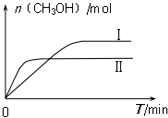
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<c≤1.
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
12.乙酸、碳酸、苯酚的酸性由强到弱的顺序是( )
| A. | 碳酸、苯酚、乙酸 | B. | 乙酸、碳酸、苯酚 | C. | 碳酸、苯酚、乙酸 | D. | 苯酚、碳酸、乙酸 |
9.既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是( )
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 通入水中 |
6.既能与稀硫酸反应,又能与NaOH溶液反应,且都有气体放出的是( )
| A. | NaHCO3 | B. | Al(OH)3 | C. | (NH4)2CO3 | D. | Al2O3 |
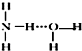 …”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为
…”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为